![]() Número 23,
enero, 2024: 1–21
Número 23,
enero, 2024: 1–21
ISSN versión impresa: 2071–9841 ISSN versión en línea: 2079–0139 https://doi.org/10.33800/nc.vi23.345
MARIPOSAS (LEPIDOPTERA: PAPILIONOIDEA)
DEL PARQUE BOTÁNICO DE CAMAGÜEY, CUBA
Butterflies (Lepidoptera: Papilionoidea) from Camagüey Botanical Park, Cuba
Marisela de la Caridad Guerra Salcedo1a, Isidro Eduardo Méndez Santos1b, Jesús Ávila Herrera2, Roeris González-Sivilla1c* y Carlos M. Morales Crespo1d
1 Universidad de Camagüey “Ignacio Agramonte Loynaz”, Centro de Estudios de Gestión Ambiental, Carretera de Circunvalación norte, Km. 5 ½, CP 70100, Camagüey, Cuba, 1a https://orcid.org/0000-0002-9538-0493, mariselacgs15@gmail.com; 1b https://orcid.org/0000-0002-0437-8057, iemendezs58@gmail.com; 1c https://orcid.org/0000-0002-9877-2070; 1d https://orcid.org/0000-0002-1708-551X, carlosmanuel56m@ gmail.com. 2 Parque Botánico de Camagüey, Carretera Central Este, Km 5 ½, CP 70700, Camagüey, Cuba, https://orcid.org/0000-0001-5010-4041, avilaherreraj524@gmail.com. *Para correspondencia: roeris1976@gmail.com.
[Recibido: 04 de julio, 2023. Aceptado: 03 de noviembre, 2023]
RESUMEN
Como resultado de un proyecto destinado al manejo sostenible de la lepidopterofauna, se socializa la relación taxonómica de las mariposas (Lepidoptera: Papilionoidea) registradas en el Parque Botánico de Camagüey, Cuba y se ofrecen datos sobre su presencia en diferentes épocas del año, con vistas a seleccionar aquellas más propicias para ser criadas en el mariposario, que se encuentra todavía en proceso de construcción. Durante los años 2021 y 2022, se realizaron muestreos mensuales en diferentes espacios del área de estudio, lo que permitió identificar 56 táxones infraespecíficos, pertenecientes a 48 géneros, 15 subfamilias y cinco familias (Papilionidae, Nymphalidae, Pieridae, Lycaenidae y Hesperiidae). El endemismo a nivel específico alcanzó el 3.57 % y en el ámbito subespecífico llegó a ser del 8.92 %, por lo que el 12.5 % de los táxones tienen distribución limitada al territorio nacional. Se comprobó que 35 de las especies/subespecies reportadas, están presentes tanto en los meses de lluvia como en los de sequía (índice de similitud de Jaccard del 62.5 % entre ambas épocas), lo que se identifica como una potencialidad para fomentar la crianza de las mismas. De acuerdo al estudio realizado, se ofrecen, en un primer intento, argumentos sobre la selección de las especies para la cría.
Palabras clave: lepidopterofauna, endemismo, índice de similitud, conservación ex situ.
ABSTRACT
As a result of a project aimed at the sustainable management of the lepidopterofauna, the taxonomic relationship of butterflies (Lepidoptera: Papilionoidea) registered in the Botanical Park of Camagüey, Cuba is presented and data on their presence at different times of the year are offered, in order to select those more adequate to being raised in the butterfly farm, which is still under construction. During 2021 and 2022, monthly samplings were carried out in different sites of the study area, which allowed the identification of 56 infraspecific taxa, belonging to 48 genera, 15 subfamilies and five families (Papilionidae, Nymphalidae, Pieridae, Lycaenidae and Hesperidae). The endemism at the specific level reached 3.57 % and in the subspecific level it reached 8.92 %, so that 12.5 % of the taxa have distribution limited to the national territory. It was found that 35 of the species/subspecies reported, are present both in the months of rain and drought (Jaccard similarity index of 62.5 % between both seasons), which is identified as a potential to promote the breeding of the same. According to the study carried out, arguments on the selection of species for breeding are offered in a first attempt.
Keywords: lepidopterofauna, endemism, similarity index, ex situ conservation.
INTRODUCCIÓN
El Consejo Popular “Julio Antonio Mella” y la Universidad de Camagüey “Ignacio Agramonte Loynaz”, en su condición de asesora, lograron en 2017 que el Programa de Pequeñas Donaciones del Fondo para el Medio Ambiente Mundial (perteneciente al Programa de las Naciones Unidas para el Desarrollo) y el Fondo Nacional de Medio Ambiente de la República de Cuba, asignaran un financiamiento para construir un mariposario en el Parque Botánico de Camagüey.
Dado que la nueva instalación aspira tanto a la sostenibilidad como a realizar un significativo aporte a la conservación de la biodiversidad, trabajará prioritariamente con recursos locales (mariposas, plantas hospederas, nectaríferas, entre otros). Para ello se necesita, ante todo, de un estudio riguroso de las especies de Papilionoidea representadas en el área, de manera que puedan seleccionarse aquellas con mayor potencialidad para ser manejadas ex situ e implementar tecnologías apropiadas en función de su crianza.
Por otra parte, el estudio de las especies de mariposas representadas en el Parque Botánico de Camagüey, constituirá un valioso referente para poder evaluar en el futuro el servicio de refugio a la fauna que realice la institución, ubicada dentro del propio ámbito urbano. Permitirá, también, estimar la contribución potencial que pueda realizarse desde allí a la conservación de este grupo zoológico y conocer mejor aquellos elementos de la lepidopterofauna con los cuales podrán interactuar los visitantes.
OBJETIVOS
- Revelar la relación taxonómica de las mariposas (Lepidoptera: Papilionoidea) que están actualmente en existencia en el Parque Botánico de Camagüey y caracterizarlas, desde el punto de vista biogeográfico.
- Analizar la representatividad de táxones en los diferentes espacios del parque y épocas del año.
- Seleccionar táxones promisorios para iniciar su cría en el mariposario.
MATERIALES Y MÉTODOS
Área de estudio
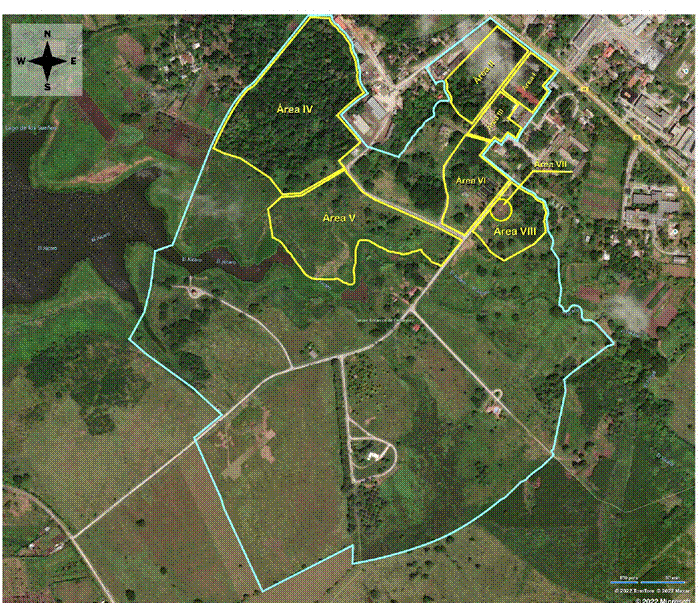
Figura 1. Imagen del Parque Botánico de Camagüey, en la que se muestran las áreas estudiadas. La línea azul corresponde a los límites exteriores, mientras que la línea amarilla representa los límites interiores entre las áreas temáticas de la entidad. Material utilizado: Imagen satelital tomada de https://www.bing.com/maps/?cp=21.351626%7E-77.878254&lvl=16.3&style=a. Composición: Roeris González Sivilla.
El estudio se realizó en el Parque Botánico de Camagüey, localizado en la ciudad y provincia homónima, perteneciente a la República de Cuba. El mismo forma parte del Consejo Popular Julio Antonio Mella, ubicado en el cuadrante sureste del perímetro urbano y se encuentra aledaño a la Carretera Central, vía al Este, km 5 ½ (donde se encuentra su entrada) y al Micro Embalse No. 17 “Monte Carlos”, a la vez que limita al sur con el Camino de Jagüey. Ocupa una extensión superficial de alrededor de 72 ha, cuyo punto central se encuentra en las coordenadas:
21.350905 -77.879276 (Fig. 1).
La institución, que abrió al público el 6 de septiembre de 2015, fue establecida en terrenos que anteriormente estuvieron dedicados a la producción agrícola para el autoconsumo del Instituto Politécnico “Álvaro Barba Machado” (antigua Granja Escuela de Camagüey), con el cual limita al noreste. Incluyó también un reducto de bosque semideciduo algo antropizado y un aboretum, ambos situados hacia el noroeste, que venían siendo utilizados por la Empresa Forestal Integral del Ministerio de la Agricultura para la producción de semillas (Méndez, 2018). Como parte de la readaptación del espacio a los objetivos del Parque Botánico, se han agregado durante los últimos siete años, entre otras: una plantación de bambúes (bambusetum), un área de vivero y un organopónico, a la vez que se ha incrementado considerablemente la superficie con jardinería diversa.
Muestreos. El muestreo se realizó durante los años 2021 y 2022, en espacios bien delimitados y con mayor desarrollo de vegetación dentro del parque. Estos fueron:
I) Jardín, con predominio de plantas suculentas y xerófitas en general.
II) Cafetal, con aislados árboles de sombra, nativos y exóticos; estrato herbáceo y arbustivo controlado mediante atenciones culturales.
III) Jardín, donde predominan plantas ornamentales herbáceas, arbustivas y arbóreas, en su mayoría exóticas.
IV) Bosque, compuesto por una plantación de árboles maderables, estrato herbáceo y arbustivo escasamente desarrollado o inexistente.
V) Sabana húmeda, con plantación de bambúes; estrato herbáceo y arbustivo controlado mediante atenciones culturales.
VI) Vivero, donde se cultivan diferentes tipos de plantas cubanas y exóticas, con vistas a ampliar las colecciones del parque, actualmente en desarrollo.
VII) Organopónico, con cultivo de hortalizas.
VIII) Zona en barbecho, formada por vegetación herbácea y aislados arbustos o árboles en crecimiento; flora compuesta mayormente por especies segetales y ruderales.
Entre ellas se establecieron recorridos lineales para la observación directa, divididos en secciones, con un total de hasta 500 metros (Mancina & Cruz, 2017). Cada recorrido tuvo una duración de una hora, siempre en el período comprendido entre 9:00 a. m. y 1:00 p. m. Se registraron todas las especies de mariposas observadas durante el recorrido, a la vez que se tomaron otras notas necesarias para el posterior procesamiento de la información. Cuando no fue posible observar los especímenes en reposo mientras se alimentaban, se procedió a su captura utilizando como técnica de colecta la búsqueda guiada con red entomológica. Los ejemplares apresados fueron liberados a su medio natural luego de ser identificados de visu, pero aquellos en los que no fue posible, se inmovilizaron y se colocaron en sobres de papel, con el registro correspondiente, para ser llevados posteriormente al laboratorio de Zoología de la Universidad de Camagüey “Ignacio Agramonte Loynaz”, donde se procedió a su montaje y a la determinación definitiva de la especie o subespecies a la que correspondía.
La identificación se realizó mediante la comparación de evidencias fenotípicas de los especímenes con descriptores de los diferentes táxones, claves y guías (Alayo & Hernández, 1987; Barro & Núñez, 2011; Mancina et al., 2020; Warren et al., 2020), la comparación con especímenes de colecciones científicas y la consulta a especialistas. La nomenclatura y la taxonomía, se asumió según aparece reportada en la red Facilitador Global de Información sobre Biodiversidad o GBIF por sus siglas en inglés (Global Biodiversity Information Facility Secretariat, 2023). Solo se exceptúa el caso de Hamadryas amphichloe diasia (Fruhstorfer, 1916), para la cual se asumieron los criterios de Garzón-Orduña et al. (2017).
Con las mariposas identificadas se confeccionó una relación taxonómica, en la cual se declara: superfamilia, familia, subfamilia, género, especie o subespecie a la que pertenecen. Se calcularon las frecuencias relativas de endemismo a nivel específico y subespecífico. Se realizó una caracterización biogeográfica utilizando como referentes las obras de Fontenla y de la Cruz (1989, 1992). También, se valoró la representatividad de mariposas con respecto a la registrada para el país y la provincia.
Se constató la presencia de cada uno de los táxones en diferentes épocas del año. Se calculó el índice de similitud de Jaccard (Jaccard index). Los datos fueron procesados a través del software PAST 3.0 para Windows (Hammer et al., 2001), en función de determinar la similitud entre los meses muestreados y entre los periodos de lluvia y seca.
RESULTADOS Y DISCUSIÓN
Composición taxonómica. Se constató la presencia de 56 táxones infragenéricos (Fig. 2) de mariposas en el Parque Botánico de Camagüey (Tabla I). Ello constituye el 28 % del total reportado para Cuba (Mancina et al., 2020) y el 44.6 % registrado en la provincia de Camagüey (Fernández & Rodríguez, 1998). Si bien dicha riqueza taxonómica no es alta con relación a la existente en otras regiones del país (Lauranzón et al., 2013; Luna & Hernández, 2013; Núñez, 2004, 2010, 2011, 2012; Núñez & Barro, 2003), sí puede ser considerada representativa de la registrada en localidades estudiadas en el ámbito provincial.
Los táxones identificados se clasifican en 48 géneros y 15 subfamilias. Están representadas cinco (Papilionidae, Nymphalidae, Pieridae, Lycaenidae y Hesperiidae) de las seis familias registradas para Cuba. Solo Riodinidae no está presente, lo cual no sorprende, dada la escasa presencia, restringida distribución y especificidad ecológica que caracterizan a la única especie Dianesia carteri (Holland 1902) registrada en el país (Alayo & Hernández, 1987; Fontenla, 1987; Núñez & Barro, 2012).
Tabla I. Relación taxonómica de mariposas (Lepidoptera: Papilionoidea) del Parque Botánico de Camagüey. * Especies endémicas; ** subespecies endémicas; *** especie introducida.
|
Fam. |
Subfamilia |
Taxon |
|
|||
|
|
Papilioninae Latreille, [1802] |
Battus polydamas cubensis (Dufrane, 1946) ** |
|
|||
|
Battus devilliers (Godart, 1823) |
|
|||||
|
Heraclides andraemon andraemon Hübner [1823] |
|
|||||
|
Heraclides androgeus epidaurus (Godman & Salvin, 1890) |
|
|||||
|
Papilio demoleus malayanus (Wallace, 1865) *** |
|
|||||
|
|
Eudaminae Mabille, 1877 |
Cetropterus dorantes santiago (Lucas, 1857) |
|
|||
|
Urbanus proteus domingo (Scudder, 1872) |
|
|||||
|
Telegonus habana (Lucas, 1857) * |
|
|||||
|
Hesperiinae Latreille, 1809 |
Asbolis capucinus (Lucas, 1857) |
|
||||
|
Calpodes ethlius (Stoll, 1782) |
|
|||||
|
Cymaenes tripunctus tripunctus (Herrich-Schäffer, 1865) |
|
|||||
|
Choranthus radians (Lucas, 1857) |
|
|||||
|
Euphyes cornelius cornelius (Latreille, 1824)** |
|
|||||
|
Hylephila phyleus phyleus (Drury, 1773) |
|
|||||
|
Nyctelius nyctelius nyctelius (Latreille, 1824) |
|
|||||
|
Panoquina lucas lucas (Fabricius, 1793) |
|
|||||
|
Panoquina ocola ocola (Edwards, 1863) |
|
|||||
|
Perichares philetes (Gmelin, 1790) |
|
|||||
|
Polites baracoa baracoa (Lucas, 1857) |
|
|||||
|
Synaptes malitiosa (Herrich-Schäffer, 1865) |
|
|||||
|
Wallengrenia misera (Lucas, 1857) |
|
|||||
|
Pyrginae Burmeister, 1878 |
Burnsius oileus (Linnaeus, 1767) |
|
||||
|
Ephyriades brunnea brunnea (Herrich-Schäffer, 1864) |
|
|||||
|
Erynnis zarucco (Lucas, 1857) |
|
|||||
|
|
Coliadinae Swainson, 1821 |
Abaeis nicippe (Cramer, 1779) |
|
|||
|
Anteos clorinde (Godart, [1824]) |
|
|||||
|
Aphrissa orbis (Poey, 1832) |
|
|||||
|
Eurema daira palmira (Poey, [1852]) |
|
|||||
|
Natalis iole Boisduval, 1836 |
|
|||||
|
Phoebis agarithe antillia Brown, 1929 |
|
|||||
|
Phoebis philea philea (Johansson, 1763) |
|
|||||
|
Phoebis sennae sennae (Linnaeus, 1758) |
|
|||||
|
Phoebis statira cubana d´Almeida, 1939 |
|
|||||
|
Pyrisitia lisa euterpe (Ménétriés, 1832) |
|
|||||
|
Pyrisitia nise nise (Cramer, 1775) |
|
|||||
|
Pierinae Swainson, 1820 |
Ascia monuste eubotea (Godart, 1819) |
|
||||
|
Glutophrissa drusilla poeyi (Butler, 1872) |
|
|||||
|
Fam. |
Subfamilia |
Taxon |
|||
|
|
Polyommatinae Swainson, 1827 |
Leptotes cassius theonus (Lucas, 1857) |
|||
|
Hemiargus ceraunus filenus (Poey, 1832) |
|||||
|
Theclinae Swainson, 1831 |
Strymon limenia (Hewitson, 1868) |
||||
|
Strymon martialis (Herrich-Schäffer, 1864) |
|||||
|
|
Biblidinae Bois-duval, 1833 |
Hamadryas amphichloe diasia (Fruhstorfer, 1916) |
|||
|
Cyrestinae Guenée, 1865 |
Marpesia eleuchea eleuchea (Hübner, 1818)** |
||||
|
Danainae Bois-duval, [1833] |
Danaus gilippus berenice (Cramer, 1779) |
||||
|
Heliconiinae Swainson, 1822 |
Dione vanillae insularis (Maynard, 1889) |
||||
|
Dryas iulia nudeola (Bates, 1934) ** |
|||||
|
Euptoieta hegesia hegesia (Cramer, 1779) |
|||||
|
Heliconius charithonia ramsdeni Comstock y Brown, 1950 |
|||||
|
Limenitinae Behr, 1864 |
Adelpha iphicleola iphimedia Fruhstorfer, 1915** |
||||
|
Nymphalinae Rafinesque, 1815 |
Anartia jatrophae guantanamo Munroe, 1942 |
||||
|
Anthanassa frisia frisia (Poey, 1832) |
|||||
|
Historis odius odius (Fabricius, 1775) |
|||||
|
Junonia lavinia Cramer, 1775 |
|||||
|
Phyciodes phaon phaon (Edwards, 1864) |
|||||
|
Siproeta stelenes biplagiata (Fruhstorfer, 1907) |
|||||
|
Satyrinae Boisduval, [1833] |
Calisto herophile Hübner, 1823* |
||||
Según se muestra en la Tabla II, las familias mejor representadas fueron Hesperiidae, Nymphalidae y Pieridae, como es de esperar para la fauna cubana (Fontenla, 1987; 1992; Mancina et al., 2020). La representatividad, con respecto a lo reportado para la provincia de Camagüey, fue más alta en Papilionidae y Hesperiidae. Los representantes de la familia Lycaenidae son escasos, lo cual corrobora la tendencia que tiene esta familia de habitar con mayor frecuencia en costas y bosques no asociados a montañas (Fontenla, 1992).
Al analizar los resultados desde una perspectiva biogeográfica, se constata que, de los 135 táxones infragenéricos registrados en la región zoogeográfica central del país (Fontenla & de la Cruz, 1989), el 41.5 % se localiza en el Parque Botánico.
Si bien era de esperar la presencia en el Parque Botánico de la mayor parte de los táxones registrados, dada la distribución anteriormente conocida de los mismos, existen al menos dos situaciones que merecen un análisis particular. Una de ellas es el caso de Strymon martialis, considerada rara en el territorio nacional (Alayo & Hernández, 1987) y observada mayormente en la vegetación cercana a las costas (Barro et al., 2020). Sin embargo, había sido registrada dos veces en el interior de la provincia de Camagüey (Fernández & Rodríguez, 1998; Fernández, 2007), una de ellas al norte de la ciudad capital, por lo que la constatación ahora de su presencia en el área objeto de estudio, reafirma lo planteado por Fernández (2007) respecto a que, estudios sistemáticos de campo, pudieran llevar a modificar concepciones que se han tenido hasta ahora sobre la distribución, ecología y abundancia atribuida a algunas mariposas cubanas.

Figura 2. Ejemplos de mariposas presentes en el Parque Botánico de Camagüey. A) Heraclides andraemon andraemon; B) Danaus gilippus berenice; C) Agraulis vanillae insularis; D) Leptotes cassius theonus; E) Battus polydamas cubensis; F) Calisto herophile; G) Pyrisitia lisa euterpe. De la A a la D, las fotos son de la autoría de Jesús Ávila Herrera y de la E a la G, fueron realizadas por Marisela de la C. Guerra Salcedo.
Tabla II. Representatividad de las familias de mariposas en el Parque Botánico de Camagüey, comparado con lo reportado para Cuba y la provincia.
|
Familias |
Número de especies y subespecies |
Proporción |
|||
|
P. Botánico |
Camagüey |
Cuba |
P. Bot. / Cam. (%) |
P. Bot. / Cuba (%) |
|
|
Hesperiidae |
19 |
40 |
57 |
47.5 |
33.3 |
|
Nymphalidae |
15 |
35 |
72 |
42.8 |
20.3 |
|
Pieridae |
13 |
29 |
35 |
44.8 |
37.1 |
|
Papilionidae |
5 |
9 |
15 |
55.5 |
33.3 |
|
Lycaenidae |
4 |
12 |
20 |
33.3 |
20 |
|
Riodinidae |
0 |
0 |
1 |
0 |
0 |
|
Total |
56 |
125 |
200 |
44.8 |
28 |
Otro análisis particular lo merece Papilio demoleus malayanus, llamativa mariposa que, de acuerdo con las observaciones realizadas desde el 2017 por los autores del presente trabajo, es relativamente común en diferentes áreas del Parque Botánico. De origen asiático, fue registrada por primera vez en Cuba durante el año 2007, en el Yunque, Baracoa, provincia de Guantánamo (Núñez, 2007). Con posterioridad, reportada para Santiago de Cuba (Lauranzón et al., 2011) y en Los Hoyos, en la costa norte de la ciudad de Gibara, provincia Holguín (Bermúdez, 2011). En Camagüey, el primer registro de su presencia se concretó en 2013 en el Reparto Jayamá, dentro de la propia ciudad capital. Luego, en el mismo año, se observó en el área protegida “La Belén”, Sierra del Chorrillo, en Najasa (Fernández & Minno, 2015). Dada su evidente tendencia a extender su presencia, la especie ha sido considerada invasora (Lauranzón et al., 2011).
La existencia de endemismos cubanos es escasa entre las mariposas registradas. Sólo clasifican en esta categoría, el 3.57 % de las especies y el 8.9 % de las subespecies. En cuanto a las primeras, están presentes: Calisto herophile y Telegonus habana, que son comunes y con amplia distribución en el territorio nacional. Entre las segundas, se destacan: Battus polydamas cubensis, Euphyes cornelius cornelius, Marpesia eleuchea eleuchea, Dryas iulia nudeola y Adelpha iphicleola iphimedia, las cuales, por lo general, también son consideradas de amplia distribución en el país (Álvarez et al., 2020; Azor y Barro, 2014; Fernández et al., 2020; Fontenla et al., 2022; Núñez et al., 2020); mientras D. iulia nudeola es común en diversos hábitats.
El hecho de que, en el espacio estudiado, el endemismo entre las subespecies sea cuantitativamente superior al que se aprecia en el caso de las especies, se corresponde con lo planteado por Fontenla y de la Cruz (1992), quienes sostienen que, en Cuba, las primeras han logrado mayor adaptabilidad que las segundas a la diversidad geográfica y ecológica, por lo que exhiben, de manera general, más amplia distribución, resultado de su mayor adaptabilidad.
Debe tenerse en cuenta que, el Parque Botánico constituye una entidad de reciente creación, al iniciar sus servicios en 2015, donde la mayor parte de sus espacios estuvieron dedicados anteriormente a la actividad agrícola y que, además, se ubica dentro de una zona urbana. Es de esperar entonces que los táxones faunísticos de amplia distribución y asociados a la actividad humana predominen con relación a los endémicos. Ello también se encuentra en consonancia con lo planteado por Fontenla y de la Cruz (1992), quienes comprobaron que el endemismo absoluto y relativo de las mariposas cubanas, es más bajo en los hábitat agrícolas, urbanos y costeros, que son también los de menor riqueza taxonómica. Además, el área estudiada se localiza en la región central del país, caracterizada por la presencia de un menor número de especies y de endemismos, en comparación con el resto del territorio nacional, por tratarse de terrenos predominantemente llanos y, por lo general, con avanzado grado de antropización (Fontenla & de la Cruz, 1989).
Los datos anteriormente expuestos indican que, al menos desde el punto de vista de la riqueza taxonómica de la lepidopterofauna local, se identifican amplias potencialidades para el fomento del mariposario que se construye en el Parque Botánico de Camagüey. Se aprecia, inclusive, la posibilidad de incorporar a la cría controlada algún taxon autóctono o endémico, lo cual permitiría lograr determinada exclusividad en los resultados que se alcancen y relativa especificidad en los servicios que se presten al público.
Representatividad de los táxones. La representatividad de las mariposas observadas en los diferentes espacios objeto de muestreo se expone en la Figura 3. Como se aprecia, la mayor cantidad de táxones (43; 76.78 %) se registró en el área VI, del Parque Botánico, lo que puede explicarse por la amplia disponibilidad de recursos en ella presente, lo cual asegura la amplia heterogeneidad de especies vegetales que conviven allí (bien sea en condiciones de cultivo o de manera espontánea) y que pueden actuar como hospederas o como proveedoras de néctar. En esta área, según observaciones realizadas por los autores, se avistaron también huevos y larvas sobre las hospederas.
Otras dos áreas en las que se registraron un número considerable de especies y subespecies fueron: el área II (35 táxones; 62.5 %) y el área III (34; 60.7 %). En ambos casos resalta la abundancia de plantas que son utilizadas por las mariposas como fuente de néctar.
En el área IV, de maderables cubanos, se observaron 31 táxones (57.14 %) y, como era de esperar, se encontraron especies que suelen habitar en los bosques y arbolados como, por ejemplo: B. polydamas cubensis, Historis odius odius, A. iphicleola iphimedia, Siproeta stelenes biplagiata y Synapte malitiosa malitiosa.
En este mismo orden, un número menor de mariposas fueron registradas en las áreas:
V (24; 42.85 %), VII (20; 35.71 %) y VIII (14 táxones; 25 %).
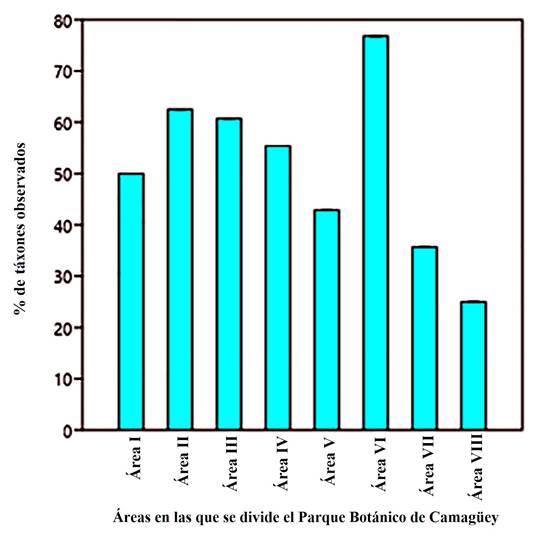
Figura 3. Representatividad de mariposas (Lepidoptera: Papilionoidea) en las zonas y áreas muestreadas en el Parque Botánico de Camagüey.
El área del vivero fue identificada como el más importante polígono para realizar los estudios que permitieran seleccionar las especies a incorporar a la cría y, una vez elegidas, proceder a la captura de pies de crías de las mismas en los diferentes estadios del ciclo vital del lepidóptero, aspecto esencial para el éxito del mariposario (Saragos & Dénommée, 2012). Igualmente, a partir de nuevas investigaciones, constituye un escenario propicio para liberar y monitorear la adaptación al medio natural de individuos maduros que hayan sido obtenidos de manera controlada, lo cual, de acuerdo con Dénommée (2010), debe alcanzar hasta un 20 % de la producción total de la entidad y que constituye un objetivo primordial del proyecto que se acomete en Camagüey. También esta acción se tendrá en cuenta como una posibilidad orientada a la restauración de los espacios que estas especies requieren para aumentar sus poblaciones.
Representatividad de táxones en los meses muestreados y similitud. El estudio de la presencia de los táxones registradas en el parque y su fenología a lo largo del año, adquiere especial importancia para el futuro funcionamiento del mariposario (Constantino, 2002; Dénommée, 2010; Saragos & Dénommée, 2012). Aportará información básica para la selección de las especies a incorporar a la crianza, la identificación de los momentos más propicios para el acopio de los pies de cría necesarios en cada caso (en cualquiera de los estadios de su ciclo vital), la planificación de los períodos y el estado en que podrán ser exhibidas al público, así como la programación de las liberaciones al medio natural.
En base a los criterios anteriores, los meses en que mayor número de táxones se observaron fueron (Fig. 4): noviembre (30), agosto (28) y julio (25). Evidentemente, es en estos cuando mejores condiciones ambientales se presentan para la actividad de los imagos, lo cual deberá estudiarse con detenimiento, como parte de la continuidad del presente proyecto, en función de lograr parámetros similares en la sala de vuelo y garantizar la sostenibilidad en la exhibición y reproducción.
Los meses con un alto número de táxones (junio, julio, agosto), corresponden al período de mayor humedad, lo cual coincide, en parte, con estudios realizados en otras áreas camagüeyanas (Fernández, 2007). Por otra parte, los meses con menos representación fueron septiembre, enero y abril.
Si bien la situación apreciada en enero entra en contradicción con los resultados obtenidos en investigaciones anteriores, se considera que se debió a circunstancias favorables que se dieron puntualmente en el período en el cual se realizó el muestreo realizado por Fernández (2007). Al respecto, para el presente estudio, este pico tuvo lugar en noviembre y diciembre, asociado a las lluvias que se produjeron en el último semestre del año.
En el estudio realizado fue necesario discernir entre aquellas mariposas que están presentes a lo largo del año, de otras que son estacionales y permanecen o tienen mayor abundancia en períodos concretos. En tal caso, las primeras pueden exhibirse todo el año, las segundas sólo en determinada estación.
En este contexto se analizó el número de táxones representados con referencia a los dos períodos que se distinguen con mayor nitidez, en cuanto a la manifestación de variables meteorológicas en Cuba, el seco y el de lluvia, lo cual aporta información sobre la mayor o menor dependencia de estos ante las variables físicas del ambiente, que distinguen dichas estaciones (temperatura, presión, humedad, radiación solar) y que tienen una influencia importante en el manejo de las mariposas en cautiverio (Sánchez, 2019) (Fig. 5). Como es de esperar, el mayor número de especies/subespecies se encuentra en el período lluvioso.
Llama la atención los casos de Telegonus habana y A. iphicleola iphimedia, que solo se observaron uno o dos veces en todo el año, lo que puede estar dado por su especificidad ecológica y no encontrar las condiciones propicias para un establecimiento permanente, particularmente esta última, considerada poco común (Alayo & Hernández, 1987; Núñez et al., 2020).
Por otra parte, el comportamiento específico de los táxones en cada uno de los meses del año, aporta elementos más amplios respecto a la interacción que establecen con los factores bióticos. En este sentido, es necesario destacar algunos ejemplos como la correspondencia entre los distintos estados del ciclo de vida de las mariposas y la fenología de las plantas hospederas y nectaríferas o la abundancia de depredadores en determinados meses.
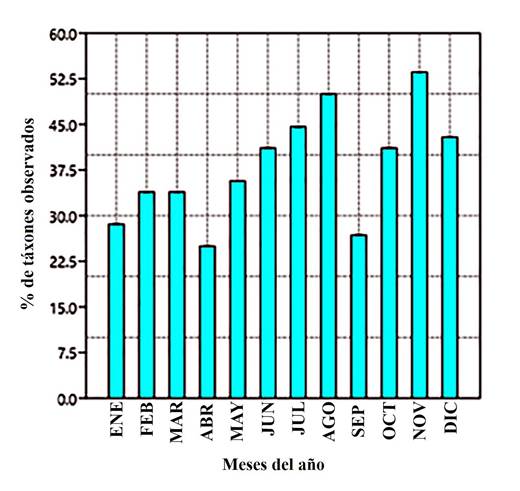
Figura 4. Representatividad de mariposas (Lepidoptera: Papilionoidea) en cada uno de los meses muestreados en el Parque Botánico de Camagüey.
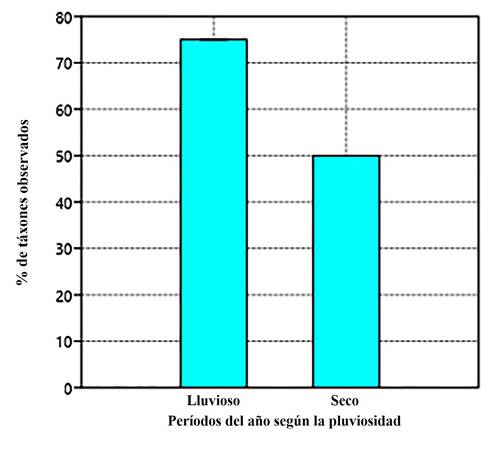
Figura 5. Representatividad de mariposas (Lepidoptera: Papilionoidea) en los periodos seco y lluvioso, que se distinguen en el Parque Botánico de Camagüey.
Sobre la base de un estudio inicial, se abren posibilidades para profundizar en cuáles son los parámetros ambientales óptimos para el desarrollo de los procesos de cría. Estas razones justifican que, tomando como punto de partida los datos expuestos sobre la presencia de táxones por meses del año y por estaciones, se calculó el índice de similitud de Jaccard, para ambas variables.
Como resultado de su aplicación, el índice de similitud de Jaccard mostró que, para un corte en 0.378, se identificaron tres conglomerados (Fig. 6). El primero comprende los meses de mayo-junio-julio-agosto; en este se destacan junio-julio (similitud 0.60), con el mayor grado de similitud entre todas las muestras, en tanto que mayo y agosto exhiben niveles de similitud menores. El segundo, corresponde a los meses de septiembre-octubre-noviembre-diciembre, en el que se distinguen noviembre-diciembre (0.59) y septiembre-octubre (0.52). El tercero abarca los meses de enero-febrero-marzo-abril; en este grupo sobresalen enero-febrero (0.52), mientras que marzo y abril muestran un más bajo grado de similitud.
Un análisis particular merece el comportamiento de la similitud en los períodos de lluvia y seca, ya que esta información posibilita ratificar, con mayor precisión, las especies que están presentes en ambos. También, permite, a partir de un estudio planificado, determinar las temporadas en las cuales cada uno de los táxones es de mayor abundancia (Dénommée, 2010). Dicha información resulta relevante para proyectar la exhibición de especímenes en el mariposario. Por otro lado, las fluctuaciones que se presenten en cada período pueden incidir en el desarrollo de las larvas por carencias en la disponibilidad de la planta hospedera (Constantino, 2002; Saragos & Dénommée, 2012), aspecto que resulta de gran interés para la cría.
El índice de similitud de Jaccard, según el dendrograma (Fig. 7), demuestra que la composición de las comunidades de mariposas durante los meses de lluvia y de seca son similares en un 62.5 %. Comparten 35 táxones de los 56 reportados para el Parque Botánico.
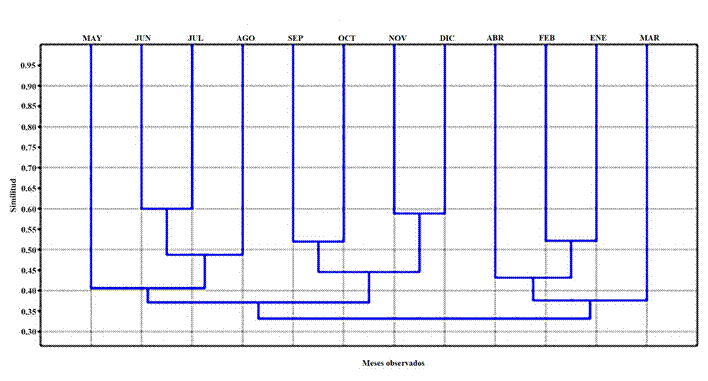
Figura 6. Dendrograma de similitud entre los meses muestreados.
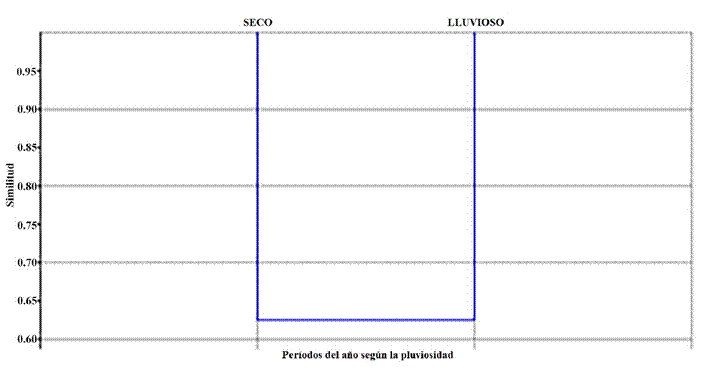
Figura 7. Dendrograma de similitud para los períodos lluvioso y seco.
Entre los ejemplos de mariposas cuya presencia coincide en la mayoría de los meses, tanto en el período de lluvia como en el de sequía, se encuentran: Agraulis vanillae insularis, Anartia jatrophae guantanamo, Ascia monustes ebonina, B. polydamas cubensis, Calisto herophile, Danaus gilippus berenice, Eurema daira palmira, Heliconius charithonius ramsdeni, Leptotes casius theonus y P. demoleus malayanus.
De este grupo fueron seleccionadas seis mariposas para su cría, reproducción y exhibición durante la primera etapa de trabajo del mariposario; B. polydamas cubensis, P. demoleus malayanus, A. monustes ebonina, D. gilippus berenice, A. vanillae insularis y H. charithonius ramsdeni.
Para la selección de estas mariposas, se tuvieron en cuenta los criterios expresados por Dénommée (2010) y por Saragos y Dénommée (2012):
- El valor estético de las mariposas, sus colores, tamaño y forma de las alas.
- La selección de táxones que fueron avistados y abundantes en todos los meses del año, lo que ofrece mayor facilidad para la obtención del pie de cría.
- La disponibilidad de hospederas, al tratarse de especies de plantas localizadas con facilidad en el parque, presentes en ambos períodos (lluvia y seca), potencialmente cultivables en la cuantía necesaria y que cuentan con exigencias mínimas ecológicas para su supervivencia.
- La prioridad para especies autóctonas y endémicas de la lepidopterofauna, dado el valor que ello le ofrece a la exhibición (tal es el caso de B. polydamas cubensis).
Los autores del presente trabajo, consideran oportuno adicionar a los anteriores criterios, los que se relacionan a continuación:
- Priorizar en el cultivo de plantas hospederas y nectaríferas a aquellas que son autóctonas y endémicas, como contribución a la conservación ex situ de los valores de la flora local o regional.
- Promover a cría de las especies/subespecies de mariposas presentes en las dos estaciones (lluvia y seca), por la posibilidad de ser exhibidas durante todo el año, dado su nivel de adaptación a disímiles condiciones ambientales. Ello no implicaría renunciar a la cría de otros táxones estacionales, que resulten significativos.
- La localización en el terreno, durante los muestreos realizados, de diferentes fases del ciclo de vida de las mariposas citadas, como un indicador de la pertinencia de criarlas en cautiverio, ya que se infiere que en el parque convergen condiciones ambientales favorables para su desarrollo completo.
- En la selección resulta peculiar el caso de P. demoleus malayanus, que, a pesar de su introducción en fecha reciente, ya manifiesta una amplia distribución en toda Cuba, tanto desde el punto de vista regional, como por la variedad de ecosistemas donde se ha establecido (Mancina et al., 2020). La cría y exhibición de este taxon puede ofrecer un importante atractivo al visitante, por su tamaño, su vuelo vistoso y su belleza en cuanto a forma y diseño. Por otra parte, brinda una oportunidad para educar a la población en la trascendencia del manejo de especies exóticas invasoras, desde las afectaciones que provocan sus larvas a cultivos de importancia como los cítricos y desde esta misma perspectiva, abre la posibilidad de investigaciones futuras, respaldadas por los recursos del laboratorio del mariposario, para perfeccionar dicho manejo en agroecosistemas que incluyen la producción citrícola.
CONCLUSIONES
La composición taxonómica de mariposas (Lepidoptera: Papilionoidea) del Parque Botánico de Camagüey consta en la actualidad de 56 especies y subespecies, que clasifican en 48 géneros, 15 subfamilias y cinco familias, con un bajo endemismo, como es de esperar en áreas urbanas y correspondientes a la región zoogeográfica central. No obstante, la riqueza de táxones infragenéricos puede considerarse en los rangos normales y propicia para la realización de acciones de conservación, dirigidas a la cría y exhibición de ejemplares autóctonos, una contribución significativa a la conservación ex situ de la lepidopterofauna cubana y camagüeyana.
Las épocas de lluvia y seca presentan similitudes en la composición de mariposas, lo cual constituye una ventaja para la selección de las especies que serán criadas y exhibidas en el mariposario, pues se presentan en ambas estaciones y pueden garantizar la continuidad del proceso de cría y exhibición que tendrá lugar en condiciones artificiales.
El diagnóstico efectuado, no solo permite establecer las bases para la cría y exhibición de especímenes en el mariposario, sino que, también servirá como referente para valorar las trasformaciones que se produzcan en la lepidopterofauna del Parque Botánico y proyectar estudios posteriores a partir de estos antecedentes.
AGRADECIMIENTOS
Los autores agradecen al ingeniero Andrés
Morales Leal, Director del Parque Botánico, por permitir el acceso a esta
institución y desarrollar el trabajo sin dificultades.
REFERENCIAS
Alayo, P. & Hernández, L. R. (1987). Atlas de las mariposas diurnas de Cuba (Lepidoptera, Rhopalocera). Editorial Científico-Técnica.
Álvarez, Y., Neyra, B., Fernández, D. M., Núñez, R. & Mancina, C. A. (2020). Papilionidae. En C. A. Mancina, R. Núñez & B. Neyra (Eds.) Mariposas de Cuba. Guía de campo.
Editorial AMA. https://www.undp.org/sites/g/files/zskgke326/files/2023-04/Mariposas_ Cuba_Guia_d_Campo_2020.pdf
Azor, L. & Barro A. (2014). Modelación de la distribución potencial de mariposas endémicas cubanas (Lepidoptera: Papilionoidea). Revista Cubana de Ciencias Biológicas, 3(3), 18–30. https://revistas.uh.cu/rccb/article/view/1747/1549
Barro, A., Loiz, C., Fernández, D. M., Núñez, R. & Mancina, C. A. (2020). Lycaenidae. En C.A. Mancina, R. Núñez & B. Neyra (Eds.) Mariposas de Cuba. Guía de campo. Editorial AMA. https://www.undp.org/sites/g/files/zskgke326/files/2023-04/Mariposas_Cuba_Guia_d_ Campo_2020.pdf
Barro, A. & Núñez, R. (2011). Lepidópteros de Cuba. Spartacus-säätiö – Spartacus Foundation & Sociedad Cubana de Zoología.
Bermúdez, F. (2011). Registro de Papilio demoleus (Linnaeus, 1758) en el norte de Holguín, Cuba (Lepidoptera: Papilionidae). Boletín de la Sociedad Entomológica Aragonesa, (49), 282. http://sea-entomologia.org/Publicaciones/PDF/BOLN_49/282BSEA49NBPapiliodem oleusCuba.pdf
Constantino, L. M. (2002). Zoocría de mariposas diurnas Rhopalocera en bosques húmedos tropicales del oriente antioqueño. Corporación Autónoma Regional Rionegro Nare. http://www.bio-nica.info/Biblioteca/Constantino2002ZoocriaMariposas.pdf
Dénommée, L. (2010). La cría de mariposas diurnas y su gestión para la producción de artesanías en la comunidad «Niños Héroes de Chapultepec» Tenosique, estado de Tabasco, México. [Tesis de Maestría, Université De Sherbrooke]. https://biblioteca.ecosur.mx/cgibin/koha/opac-retrieve-file.pl?id=284755d45f3cb5454d7ec5d17b803c37
Fernández, D. M. (2007). Butterflies of the Agricultural Experiment Station of Tropical Roots and Tubers, and Santa Ana, Camagüey, Cuba: An annotated list. Acta Zoologica Mexicana
Nueva serie, 23(2), 43–75. http://www.scielo.org.mx/scielo.php?script=sci_arttext&pid =S0065-17372007000200004
Fernández, D. M., Álvarez, Y., Barro, A., Núñez, R. & Mancina, C. A. (2020). Hesperiidae. En C. A. Mancina, R. Núñez & B. Neyra (Eds.) Mariposas de Cuba. Guía de campo.
Editorial AMA. https://www.undp.org/sites/g/files/zskgke326/files/2023-04/Mariposas_ Cuba_Guia_d_Campo_2020.pdf
Fernández, D. M. & Minno, M. C. (2015). The slowly expanding range of Papilio demoleus Linnaeus (Lepidoptera: Papilionidae) in Cuba. Tropical Lepidoptera Research, 25(1), 8–14. https://journals.flvc.org/troplep/article/view/89747
Fernández, D. M. & Rodríguez, L. (1998). Las mariposas de Camagüey (Lepidoptera: Papilionidea y Hesperioidea). Cocuyo, (7), 21–23.
Fontenla, J. L. (1987). Aspectos comparativos estructurales de tres comunidades de mariposas (Lepidoptera: Rhopalocera) en Cuba. Poeyana, (337), 1–20.
Fontenla, J. L. (1992). Biogeografía ecológica de las mariposas diurnas cubanas. Patrones generales. Poeyana, (427), 1–30. https://www.revistasgeotech.com/index.php/poey/article/ view/336
Fontenla, J. L. & de la Cruz, J. (1989). Análisis zoogeográfico preliminar de las mariposas diurnas cubanas (Reporte de investigación n° 49). Instituto de Ecología y Sistemática de Cuba.
Fontenla, J. L. & de la Cruz, J. (1992). Consideraciones biogeográficas sobre las mariposas endémicas de Cuba. Poeyana, (426), 1–34.
Fontenla, J. L., Fontenla, Y. & Mancina, C. A. (2022). Estructura biogeográfica de los endemismos de mariposas entre Tipos de Regiones Físico-Geográficas del archipiélago Cubano. Poeyana, (513), 1-21. https://revistasgeotech.com/index.php/poey/article/view/424/512
Garzón-Orduña, I. J., Brower, A. V., Kamilari, M., Iribar, A. & Murienne, J. (2017). Cracking the code: Examination of species delimitations among Hamadryas butterflies with DNA barcodes suggests caribbean cracker is Hamadryas februa Hübner (Nymphalidae: Biblidinae). Journal of the Lepidopterists’ Society, 71(4), 53–73. https://doi.org/10.18473/ lepi.72i1.a6
Global Biodiversity Information Facility Secretariat. (2023). GBIF Backbone Taxonomy. Checklist dataset. https://doi.org/10.15468/39omei
Hammer, Ø., D.A.T. Harper, D, A. T. & Ryan, P. D. (2001). PAST: Paleontological statistics software package for education and data analysis. Palaeontología Electrónica, 4(1), 1–9. https://palaeo-electronica.org/2001_1/past/past.pdf
Lauranzón, B., Gulli, G., Reyes, J., Fagilde, M. C. & Melián, L. O. (2011). Observaciones sobre Papilio demoleus (Lepidoptera: Papilionidae), una especie invasora en Cuba. Solenodon, (9),
81–87. https://caribbeanagroup.org/wp-content/uploads/2022/07/11_papilio_demoleus.pdf
Lauranzón, B., Naranjo, C. & Fagilde, M. C. (2013). Mariposas (Lepidoptera: Papilionoidea; Hesperioidea) de la provincia de Santiago de Cuba, Cuba. Solenodon, (11), 22–81. https://docplayer.es/63381848-Mariposas-lepidoptera-papilionoidea-hesperioidea-de-laprovincia-de-santiago-de-cuba-cuba.html
Luna, L. H. & Hernández, A. (2013). Mariposas diurnas (Lepidoptera: Rhopalocera) de Cayo Caguanes (Parque Natural Caguanes), Sancti Spíritus, Cuba. Boletín de la Sociedad
Entomológica Aragonesa, (52), 226–228. http://sea-entomologia.org/PDF/Boletin52/2262
28BSEA5200MariposasCaguane.pdf
Mancina, C. A., & Cruz, D. D. (Eds.). (2017). Diversidad biológica de Cuba: métodos de inventario, monitoreo y colecciones biológicas. Editorial AMA. https://www.undp.org/ sites/g/files/zskgke326/files/migration/latinamerica/7ad21eff00f4429d78375afa4a56efb4c a10963a16f3cefa0cdf8e8f7bcb30c3.pdf
Mancina, C. A., Núñez, R. & Neyra, B. (Eds.). (2020). Mariposas de Cuba. Guía de campo. Editorial AMA. https://www.undp.org/sites/g/files/zskgke326/files/2023-04/Mariposas_ Cuba_Guia_d_Campo_2020.pdf
Méndez, I. E. (2018). Concepción fundacional del Jardín Botánico de Camagüey. Agrisost, 24(3), 152–168. https://revistas.reduc.edu.cu/index.php/agrisost/article/view/2569/e49821
Núñez, R. (2004). Lepidoptera (Insecta) de Topes de Collantes, Sancti Spíritus, Cuba. Boletín de la Sociedad Entomológica Aragonesa, (34), 151–159. http://sea-entomologia.org/PDF/ BOLETIN_34/B34-025-151.pdf
Núñez, R. (2007). Papilio demoleus Linnaeus, 1758 en Cuba (Lepidoptera, Papilionidae).
Boletín de la Sociedad Entomológica Aragonesa, (41), 440. http://sea-entomologia.org/
Publicaciones/PDF/BOLN41/440_NB_BSEA_41_papilio_Cuba_.pdf
Núñez, R. (2010). Especies del orden Lepidoptera (Insecta) en el área protegida de recursos manejados “Mil Cumbres”, Pinar del Río, Cuba. Poeyana, 498, 31–38.
Núñez, R. (2011). Lista preliminar de las mariposas (Lepidoptera: Papilionoidea) de El Yunque de Baracoa, Guantánamo, Cuba. CartaCuba, 3(1), 22–24.
Núñez, R. (2012). The butterflies of Turquino National Park, Sierra Maestra, Cuba (Lepidoptera, Papilionoidea). Arxius de Miscelánea Zoológica, 10, 29–49. https://doi.org/10.32800/ amz.2012.10.0029
Núñez, R. & Barro, A. (2003). Composición y estructura de dos comunidades de mariposas (Lepidoptera, Papilionoidea) en Boca de Canasí, La Habana, Cuba. Revista Biología, 17(1), 8–17.
Núñez, R. & Barro, A. (2012). A list of Cuban Lepidoptera (Arthropoda: Insecta). Zootaxa, 3384(1), 1–59. https://doi.org/10.11646/zootaxa.3384.1.1
Núñez, R., Neira, B., Caballero, H., Fernández, D. M., Norri, T. & Mancina, C. A. (2020). Papilionidae. En C. A. Mancina, R. Núñez & B. Neyra (Eds.) Mariposas de Cuba. Guía de campo. Editorial AMA. https://www.undp.org/sites/g/files/zskgke326/files/2023-04/ Mariposas_Cuba_Guia_d_Campo_2020.pdf
Sánchez, D. D. (2019). Implementación de un sistema de monitoreo de temperatura y humedad relativa, y control de temperatura para futuro zoocriadero de lepidópteros, en el centro de biosistemas de la Universidad Jorge Tadeo Lozano. [Tesis de Grado, Universidad El
Bosque, Colombia]. https://repositorio.unbosque.edu.co/handle/20.500.12495/2615
Saragos, J. & Dénommée, L. (2012). Cría de mariposas diurnas, perspectivas para la producción de artesanías y desarrollo del ecoturismo, en una comunidad del Estado de Tabasco, México. En J. G. Chan, R. Martínez & A. Espinoza (Eds.). Manejo sostenible de los recursos naturales: conservación y experiencias. El Colegio de la Frontera Sur.
Warrent, A. D., Davis, K. J., Strangeland, M. J., Pelham, P. & Grishin, N. V. (2020). Illustrated Lists of American Butterflies (North and South America). Butterflies of America. Recuperado el 23 de junio de 2023 de https://www.butterfliesofamerica.com/L/Neotropical.htm
Cómo citar: Guerra Salcedo, M. de la C., Méndez Santos, I. E., Ávila Herrera, J., González-Sivilla, R. & Morales Crespo, C. M. (2024). Mariposas (Lepidoptera: Papilionoidea) del Parque Botánico de
Camagüey, Cuba. Novitates Caribaea, (23), 1–21. https://doi.org/10.33800/nc.vi23.345