![]() Número 22,
julio, 2023: 25–50
Número 22,
julio, 2023: 25–50
ISSN versión impresa: 2071–9841 ISSN versión en línea: 2079–0139 https://doi.org/10.33800/nc.vi22.337
ANÁLISIS DE LA COMUNIDAD VÁGIL Y SÉSIL DEL INTERMAREAL ROCOSO DE CAZONES, VERACRUZ, MÉXICO
Analysis of the vagile and sesile community of the rocky intertidal of Cazones, Veracruz, Mexico
Salvador Rodríguez-Muñoz1a, Natalia Granados-Vargas1b y Vicencio de la Cruz-Francisco1c*
1 Facultad de Ciencias Biológicas y Agropecuarias, Campus Tuxpan, Universidad Veracruzana. Carr. TuxpanTampico km 7.5, Col. Universitaria CP. 92850, Tuxpan, Veracruz, México; ahttps://orcid.org/0000-0003-1559-6858, b.m.salvador.rodriguez@gmail.com; b https://orcid.org/0009-0001-3085-4862, nattgv@hotmail.com; c https://orcid.org/0000-0001-8339-6730. *Para correspondencia: vicenciodelacruz@gmail.com.
[Recibido: 15 de abril, 2023. Aceptado: 05 de junio, 2023]
RESUMEN
El intermareal rocoso de Cazones, Veracruz ya cuenta con información de la diversidad biológica, sin embargo, es necesario conocer la estructura comunitaria bajo un enfoque cuantitativo. El objetivo del presente trabajo fue caracterizar la comunidad biológica del intermareal alto, medio y bajo en tres sitios de muestreo. En cada sitio se tendieron dos transectos de 20 m de largo en el nivel alto, medio y bajo del intermareal, y en cada transecto se colocaron a cada 5 m, dos cuadrantes de 50 x 50 cm para estimar el porcentaje de cobertura de especies sésiles y la abundancia de las especies vágiles, así mismo, se estimaron índices de diversidad alfa (riqueza de especies, dominancia, y diversidad verdadera) y se determinaron diferencias significativas entre las franjas intermareales mediante análisis multivariados. Se registraron un total de 110 especies, las cuales están agrupadas en tres reinos: Chromista, Plantae y Animalia, este último reino presentó siete filos, Mollusca fue el más diverso con 22 especies registradas. La estructura comunitaria en el nivel alto fue homogénea y poco diversa en especies y prevaleció la dominancia; bivalvos, balanos y gasterópodos fueron los más conspicuos. Hacia el intermareal medio y bajo, la riqueza de especies fue mayor y la estructura comunitaria fue heterogénea; los pastos marinos y macroalgas presentaron mayor cobertura en el sitio 1 y 2 y disminuyó hacia el nivel bajo, en este lugar la comunidad vágil fue dominante caracterizada por la abundancia de erizos y anémonas. Mientras en el nivel medio y bajo del sitio 3 la comunidad fue equitativa y se caracterizó por presentar la mayor diversidad de especies, las macroalgas fueron el principal componente de la comunidad sésil. La estructura de las comunidades intermareales y las diferencias significativas encontradas en este estudio coinciden a lo reportado para otras costas rocosas.
Palabras clave: zonación, comunidades, sésil, vágil, heterogeneidad.
ABSTRACT
The rocky intertidal of Cazones, Veracruz already has information on biological diversity; however, it is necessary to know the community structure under a quantitative approach. The objective of the present research was to characterize the biological community of the high, middle, and low intertidal zones at three sampling sites. At each site, two 20 m long transects were laid at the high, middle and low intertidal levels, and in each transect, two quadrants of 50 x 50 cm were placed every 5 m to estimate the percentage cover of sessile species and the abundance of vagile species; additionally, alpha diversity indices (species richness, dominance, and true diversity) were estimated, and multivariate analysis determined significant differences between the intertidal strips. A total of 110 species were registered, which are grouped into three kingdoms: Chromista, Plantae, and Animalia; the last-mentioned kingdom presented seven phyla, Mollusca was the most diverse with 22 species recorded. The community structure in the upper level was homogeneous and not very diverse in species, and dominance prevailed; bivalves, bernacles, and gastropods were the most conspicuous. Towards the middle and lower intertidal, the species richness was higher, and the community structure was heterogeneous; seagrasses and macroalgae presented higher coverage at sites 1 and 2 and decreased towards the lower level; at this site, the vagile community was dominant, characterized by the abundance of sea urchins and anemones. While in the middle and lower levels of site 3, the community was equitable and was characterized by presenting the highest number of species diversity; the main component of the sessile community were macroalgae. The structure of the intertidal communities and the significant differences found in this study coincide with those reported for other rocky shores.
Keywords: zonation, communities, sessile, vagile, heterogeneity.
INTRODUCCIÓN
El intermareal es uno de los ecosistemas costeros más dinámicos debido a que está sujeto a cambios constantes en los niveles de la marea, la acción de las olas, las variaciones de salinidad, también en la humedad y desecación, estos factores generan condiciones particulares para el establecimiento de comunidades biológicas (Kaiser et al., 2011). La biota marina que habita en el intermareal depende del tipo de sustrato, el cual puede ser arenoso, fangoso o rocoso (Lara-Lara et al., 2008). El intermareal de tipo rocoso es el más heterogéneo dado que su topografía es sólida, de rocas volcánicas o sedimentarias, presentan grietas y pozas de marea (Torruco et al., 2012). Este ecosistema costero es fundamental para la biota marina dado que alberga un grupo exclusivo de organismos marinos, provee áreas de refugio, crianza y alimentación (GonzálezSolís et al., 2017; Quirós & Hernando, 2013; Villamar & Cruz, 2007).
Las especies que se establecen en el intermareal rocoso son sésiles y vágiles, representadas por macroalgas e invertebrados, también, habitan peces de pequeña y mediana talla (Benedetti-Cecchi et al., 2001; De la Cruz-Francisco et al., 2017; Foster et al., 2003; OrtizGarcía et al., 2006; Quirós & Hernando, 2013; Vassallo et al., 2014). Esta comunidad biológica está adaptada para soportar el embate de las olas, la desecación, insolación, cambios en la temperatura y salinidad durante las mareas bajas, por lo que la distribución de las especies en las franjas intermareales (alto, medio y bajo) dependerá del nivel de la marea y de su capacidad para tolerar el estrés ambiental (González-Solís et al., 2017; Salazar-Vallejo & González, 1990; Vargas-Hernández & Ramírez-Rodríguez, 2006).
A lo largo de las costas de Veracruz existen zonas con acantilados y promontorios rocosos en el que se establecen importantes comunidades biológicas, los estudios que se han realizado en estos ecosistemas costeros son listados taxonómicos, siendo las macroalgas el grupo mejor estudiado seguido de los invertebrados. Este conocimiento se ha generado por lo menos en seis litorales rocosos: Montepío (Vargas-Hernández & Ramírez-Rodríguez, 2006), La Mancha (Vassallo et al., 2014), El Pulpo (De la Cruz-Francisco et al., 2017), Playa Paraíso, Playa Villa Rica y Playa Muñecos (Landa-Cansigno et al., 2019; Vargas-Hernández & RamírezRodríguez, 2006). Si bien esta información contribuye al conocimiento sobre la biodiversidad que se establece en los litorales rocosos de Veracruz, aún es necesario conocer la distribución y abundancias de las especies.
Aunado a lo anterior, el presente trabajo aporta los primeros datos de la distribución, cobertura y abundancia de la comunidad sésil y vágil que se establece en el intermareal rocoso de Cazones, Veracruz, ecosistema del que solo se tenían listados de especies de la flora y fauna marina (Álvarez et al., 2011; Correa-Sandoval & Rodríguez-Castro, 2013; De la Cruz-Francisco et al., 2017; Dreckmann, 2009; Dreckmann & Sentíes, 2009; Méndez et al., 1985; Vilchis, 2015; Zamora-Silva & Naranjo-García, 2008). Se espera que esta información pueda ser de utilidad para la toma de decisiones en materia de manejo y proveer algún tipo de explicación de la importancia biológica de este ecosistema en particular (De la Cruz-Francisco et al., 2017).
MATERIALES Y MÉTODOS
Área de estudio. Cazones de Herrera es un municipio costero y se localiza en la zona norte del estado de Veracruz; en su línea costera desemboca el río Cazones, presenta playas arenosas bajas y promontorios rocosos de arenisca. Hacia el norte, aproximadamente a 1 km de la desembocadura del río Cazones, se localiza el intermareal rocoso conocido como El Pulpo, de aproximadamente 950 m de longitud y 40 m de ancho (De la Cruz-Francisco et al., 2017), está compuesto por promontorios rocosos erosionados y presenta una plataforma de abrasión con pendiente suave que está expuesta al oleaje y a los cambios de marea; sobre la terraza abrasiva se establece una importante comunidad de flora y fauna marina y destaca una amplia pradera de Thalassia testudinum L. (Fig. 1).
En el intermareal rocoso de Cazones se establecieron tres sitios de muestreo, los cuales se caracterizan por el tipo de sustrato dominante en el intermareal medio y bajo; sitio 1 ubicado al noroeste, el sustrato bentónico es rocoso y tapizado de algas, presenta pozas de marea y canales; sitio 2 ubicado al este, caracterizado por extensas praderas de pasto marino; sitio 3 localizado al sureste se caracteriza por un sustrato mixto de arena, escombros calcáreos y restos de conchas, macroalgas y parches de pasto marino (De la Cruz-Francisco et al., 2017).
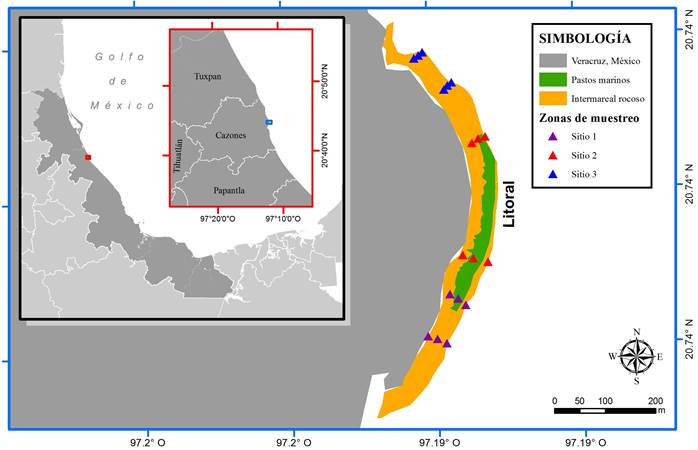
Figura 1. Localización geográfica del intermareal rocoso de Cazones y distribución de los sitios de muestreo.
La programación de los muestreos fue con base en las mareas más bajas de mayo y de noviembre de 2018, para ello se utilizó el programa MAR V1.0 (González, 2011). Para evaluar la zonación de la comunidad sésil y vágil, en cada sitio de muestreo se tendieron dos transectos de 20 m de longitud orientados paralelamente al intermareal alto, medio y bajo. Como unidad de muestreo se utilizaron dos cuadrantes de 50 cm2, mismos que se situaron a cada 5 m del transecto. En cada cuadrante se identificaron las especies sésiles y vágiles con base en sus características morfológicas y de coloración; las especies que resultaron dudosas se recolectaron en frascos y se conservaron en alcohol al 96% para su posterior identificación en el laboratorio, auxiliándose de claves y guías taxonómicas para algas (León et al., 2007; Littler & Littler, 2000), esponjas (Gómez, 2007; Hajdu & Teixeira, 2011), cnidarios (Colín-García et al., 2018; González-Muñoz et al., 2013), artrópodos (Moscoso, 2013), moluscos (García-Cubas & Reguero, 2004; Ortigosa & Simoes, 2019; Sanvicente-Añorve et al., 2012) y peces (Humann & Deloach, 2002).
Por igual, en cada cuadrante las especies vágiles, se cuantificaron numéricamente, mientras que los organismos sésiles se cuantificaron estimando el porcentaje de cobertura (%), para ello, el cuadrante de 50 cm2 se dividió en rejillas de 10 x 10 cm. Con las especies identificadas en los cuadrantes, se elaboró un listado taxonómico agrupado por Reino, Filo y Clase, mientras los géneros y especies se ordenaron alfabéticamente, esta información se complementó con observaciones realizadas en las inmediaciones de los cuadrantes y transectos, buscando en las pozas de marea, en surcos, oquedades y bajo las rocas.
Con la información cualitativa (presencia y ausencia) de las especies sésiles y vágiles, se calculó la riqueza de especies a nivel general, por sitio y por franja intermareal. Mientras, con los datos cuantitativos se elaboraron curvas acumulativas de la riqueza observada y del estimador no paramétrico Chao 2. A fin de determinar la eficiencia del muestreo realizado en cada franja intermareal, la riqueza observada (multiplicada por 100) se dividió entre el valor de la riqueza esperada de Chao 2, se consideró como eficiente el muestreo a partir de 90% de representatividad (Moreno & Halffter, 2000).
La cobertura bentónica estimada se expresó en porcentaje, criterio que también se aplicó para la abundancia numérica la cual se convirtió en abundancia relativa porcentual, estos datos se representaron por grupo taxonómico a nivel de Filo y se agruparon por sitios y franja intermareal. Las primeras 10 especies de mayor abundancia y cobertura de cada sitio y franja intermareal se representaron a través de curvas de rango abundancia, para esto, las abundancias de las especies fueron transformadas a log10 y se ordenaron de mayor a menor. También, se calcularon índices de diversidad alfa basados en la abundancia: diversidad de Shannon (H'), dominancia de Simpson (D) y diversidad verdadera de orden 1 (1D), este índice se calculó con el exponente de la diversidad de Shannon (1D= exp H’). Todos los índices ecológicos fueron calculados con el programa Past 3.08 (Hammer et al., 2001).
Finalmente, se realizó un análisis de similitud (ANOSIM) utilizando como factores “sitios y franjas intermareales” con el objetivo de determinar diferencias significativas en la comunidad intermareal (sésil y vágil) registrada en el estudio. Los datos cuantitativos se estandarizaron y se transformaron a la raíz cuadrada para minimizar el efecto de las especies más abundantes. También, se realizó un análisis de similitud empleando la distancia de Bray-Curtis, con la matriz de similitud se utilizó el método de ordenación multidimensional no métrico (nMDS) para representar las proximidades de los sitios y franjas intermareales en un gráfico de dos dimensiones, estos análisis se realizaron con el programa PRIMER 5 (Clark & Gorley, 2001). Todas las gráficas fueron elaboradas con el programa R versión 9.0.351 (R Core Team, 2021) utilizando el paquete “ggplot2” (Wickham, 2016).
RESULTADOS
Se registró un total de 110 especies en el litoral rocoso de Cazones, de las cuales, 41 corresponden al macrofitobentos y 69 representan a la macrofauna bentónica. Rhodophyta fue el grupo más diverso dentro de las macroalgas, con 21 especies, seguido de Chlorophyta, con 11 especies, destacando el registro de Thalassia testudinum como único representante de Tracheophyta.
La macrofauna está representada por varios grupos de invertebrados, desde esponjas de crecimiento incrustante y masivo (seis especies), zoántidos (dos especies), corales incrustantes y masivos como Oculina patagonica, Siderastrea radians y Siderastrea stellata. Los moluscos fueron los más diversos con 23 especies, siendo Gastropoda la clase con mayor riqueza registrada (18 especies). También se registraron ofiuras, erizos regulares y pepinos de mar que se resguardan entre las macroalgas y oquedades del sustrato rocoso. En las pozas de marea y surcos de la plataforma rocosa se registraron 10 especies de peces en fase juvenil y adulta (Tabla I). Se añaden 16 nuevos registros para el área de estudio y se amplía la distribución de Siderastrea stellata, Oculina patagonica, Phidiana lynceus y Spurilla neopolitana para la zona norte de Veracruz.
Tabla I. Listado de especies sésiles y vágiles identificadas en el intermareal rocoso El Pulpo, Barra de Cazones, Veracruz. (r) Nuevo registro, (a) ampliación de distribución, (c) especies cuantificadas.
 Categorías/Especie
Categorías/Especie
|
Phylum: Ochrophyta Clase: Phaeophyceae |
|
|
|
|
Canistrocarpus cervicornis (Kützing) De Paula & De Clerck, 2006 c |
|
* |
* |
|
Chnoosphora minima (Hering) Papenfuss, 1956 c |
|
* |
* |
|
Colpomenia sinuosa (Mertens ex Roth) Derbès & Solier, 1851 c |
|
* |
* |
|
Dictyopteris jamaicensis W. R. Taylor, 1960 c |
|
* |
* |
|
Padina gymnospora (Kützing) Sonder, 1871 c |
|
* |
* |
|
Padina pavonica (Linnaeus) Thivy, 1960 c |
* |
* |
* |
|
Sargassum sp. C |
|
* |
* |
|
Spatoglossum schroederi (C. Agardh) Kützing, 1859 c Phylum: Rhodophyta Clase: Florideophycide |
|
* |
* |
|
Acanthophora spicifera (M. Vahl) Börgesen, 1910 c |
|
|
* |
|
Aglaothamnion cordatum (Börgesen) Feldmann-Mazoyer, 1941 |
|
|
* |
|
Alsidium triquetrum (S. G. Gmelin) Trevisan, 1845 c |
|
* |
* |
|
Amphiroa fragilissima (Linnaeus) J. V. Lamouroux, 1816 c |
|
* |
* |
|
Bryothamnion seaforthii (Turner) Kützing, 1843 c |
|
* |
* |
|
Centroceras clavulatum (C. Agardh) Montagne, 1846 c |
* |
* |
* |
|
Ceramium sp. (Dumortier) Schmitz, 1889 c |
|
* |
|
|
Corallina officinalis Linnaeus, 1758 c |
|
|
* |
|
Galaxaura rugosa (J. Ellis & Solander) J. V. Lamouroux, 1816 c |
|
|
* |
|
Gelidiella acerosa (Forsskål) Feldmann & G. Hamel, 1934 c |
|
* |
* |
|
Gelidium pusillum (Stackhouse) Le Jolis, 1863 c |
|
* |
* |
|
Gracilaria sp. 1 c |
|
* |
* |
|
Gracilaria sp. 2 c |
|
|
* |
|
Gracilaria cervicornis (Turner) J. Agardh, 1852 c |
|
* |
* |
|
Gracilaria domingensis (Kützing) Sonder ex Dickie, 1874 c |
|
* |
|
|
Gracilariopsis lamaeniformis E. Y. Dawson 1964 c |
|
|
* |
|
Hypnea musciformis (Wulfen) J. V. Lamouroux, 1813 c |
|
* |
* |
|
Hypnea spinella (C. Agardh) Kützing, 1847 c |
* |
* |
* |
|
Hypnea valentiae (Turner) Montagne, 1841 c |
|
* |
|
|
Palisada perforata (Bory de Saint-Vincent) K. W. Nam, 2007 c |
|
* |
* |
|
Polysiphonia subtilissima Montagne, 1840 c |
* |
* |
|
Phylum: Chlorophyta
Clase: Ulvophyceae
![]()
|
Bryopsis hypnoides J. V. Lamouroux, 1809 c |
|
* |
* |
|
Caulerpa mexicana Sonder ex Kützing, 1849 c |
|
* |
* |
|
Caulerpa prolifera (Forsskål) J. V. Lamouroux, 1809 |
|
* |
|
|
Caulerpa racemosa (Forsskål) J. Agardh, 1873 c |
|
* |
* |
|
Caulerpa racemosa var. macrophysa W. R. Taylor, 1928 |
|
* |
* |
|
Caulerpa sertulariodes (S. G. Gmelin) M. Howe, 1905 |
|
* |
* |
|
Chaetomorpha aerea (Dillwyn) Kützing, 1849 c |
* |
* |
|
|
Cladophora vagabunda (Linnaeus) Hoek, 1963 c |
* |
* |
* |
|
Ulva flexuosa Wulfen, 1803 c |
|
* |
|
|
Ulva intestinalis Linnaeus, 1753 c |
|
* |
|
|
Ulva lactuca Linnaeus, 1753 c |
* |
* |
* |
|
Ulva prolifera O. F. Müller, 1778 c Phylum: Tracheophyta Clase: Monocotyledoneae |
|
|
* |
|
Thalassia testudinum K. D. Koenig, 1805 c Phylum: Porifera Clase: Demospongiae |
* |
* |
|
|
Cinachyrella cf. alloclada Uliczka, 1929 c |
|
* |
|
|
Cliona cf. celata Grant, 1826 c, r |
|
* |
|
|
Dragmacidon reticulatum (Ridley & Dendy, 1886) c, r |
|
* |
|
|
Lyssodendoryx (Lyssodendoryx) isodictyalis Carter, 1882 c, r |
|
* |
|
|
Placospongia cf. intermedia Sollas, 1888 c, r |
|
|
* |
|
Tedania (Tedania) ignis Duchassaing & Michelotti, 1864 c Phylum: Cnidaria Clase: Anthozoa |
|
* |
* |
|
Actinostella flosculifera Le Sueur, 1817 c |
|
* |
* |
|
Anemonia aff. sargassensis Hargitt, 1908 r |
|
|
* |
|
Bunodosoma aff. cavernatum Bosc, 1802 c |
|
* |
* |
|
Bunodosoma granuliferum Le Sueur, 1817 c |
|
* |
* |
|
Exaiptasia pallida Agassiz in Verill, 1864 |
|
* |
* |
|
Isarachnanthus nocturnus Hartog, 1977 c, r |
|
* |
* |
|
Oculina patagonica Angelis, 1908 a |
|
* |
* |
|
Protopalythoa variabilis Duerden, 1898 c |
|
* |
* |
|
Siderastrea radians Pallas, 1766 |
|
* |
* |
|
Siderastrea stellata Verrill, 1868 a |
|
* |
* |
|
Zoanthus sociatus Ellis, 1768 c |
|
|
* |
Phylum: Anellida
Clase: Polychaeta
Tabla I. Continuación
 Categorías/Especie
Categorías/Especie
|
Phyllodocida |
|
* |
|
|
|
Sabellida Phylum: Mollusca Clase: Polyplacophora |
|
* |
|
|
|
Chiton tuberculatus Linnaeus, 1758 Clase: Bivalvia |
|
* |
|
|
|
Brachidontes exustus Linnaeus, 1758 c |
* |
|
|
|
|
Dosinia sp. c |
|
* |
|
|
|
Isognomon bicolor C. B. Adams, 1845 c Clase: Gastropoda |
* |
* |
|
|
|
Aplysia dactylomela Rang, 1828 c |
|
* |
* |
|
|
Aplysia fasciata Poiret, 1789 |
|
* |
|
|
|
Bulla occidentalis A. Adams, 1850 c |
|
* |
|
|
|
Busycon contrarium Conrad, 1840 |
|
* |
|
|
|
Costoanachis avara Say, 1822 c |
|
|
* |
|
|
Diodora dysoni Reeve, 1850 c |
* |
* |
* |
|
|
Echinolittorina angustior Mörch, 1876 c |
* |
* |
|
|
|
Fasciolaria tulipa Linnaeus, 1758 c |
|
* |
|
|
|
Leucozonia nassa (Gmelin, 1791) |
|
* |
|
|
|
Navanax gemmatus Morch, 1863 r |
|
* |
|
|
|
Nerita tessellata Gmelin, 1791 c |
* |
* |
|
|
|
Nitidella nítida Lamarck, 1822 c |
|
* |
|
|
|
Oxynoe antillarum Mörch, 1863 r |
|
|
* |
|
|
Phidiana lynceus Bergh, 1867 a |
|
* |
|
|
|
Stramonita rustica Lamarck, 1822 c |
* |
* |
* |
|
|
Siphonaria pectinata Linnaeus, 1758 c |
* |
|
|
|
|
Spurilla neopolitana Delle Chiaje, 1841 a |
|
* |
|
|
|
Terebra taurina Lightfoot, 1786 Clase: Cephalopoda |
|
* |
|
|
|
Octopus insularis Leite & Haimovici, 2008 Phylum: Arthropoda Clase: Hexanauplia |
|
* |
* |
|
|
Chthamalus fragilis Darwin, 1854 c |
* |
* |
* |
|
|
Tetraclita stalactifera Lamarck, 1818 Clase: Malacostraca |
* |
|
|
|
|
Acanthonyx petiverii H. Milne Edwards, 1834 c |
|
* |
|
|
|
Eriphia gonagra (Fabricius, 1781) |
|
* |
* |
|
|
Gecarcinus lateralis Guérin, 1832 |
* |
|
|
|
|
Categorías/Especie |
Alto |
Medio |
Bajo |
||
|
Ocypode quadrata Fabricius, 1787 |
* |
|
|
||
|
Pachygrapsus transversus (Gibbes, 1850) c |
* |
|
|
||
|
Paguristes sp. Dana, 1851 c |
* |
* |
* |
||
|
Phylum: Echinodermata Clase: Ophioruoidea Amphiodia trychna H. L. Clark, 1918 c, r |
|
|
* |
||
|
Ophiothrix lineata Lyman, 1860 |
|
* |
|
||
|
Ophiothrix (Ophiothrix) orstedii Lütken, 1856 c |
|
|
* |
||
|
Clase: Echinoidea Arbacia punctulata Lamarck, 1816 c |
|
* |
* |
||
|
Echinometra lucunter Linnaeus, 1758 c |
|
* |
* |
||
|
Eucidaris tribuloides Lamarck, 1816 |
|
* |
|
||
|
Lytechinus variegatus Lamarck, 1816 |
|
* |
* |
||
|
Clase: Holothuriidae Holothuria (Thymiosycia) arenicola Semper, 1868 |
|
* |
|
||
|
Holothuria (Selenkothuria) glaberrima Selenka, 1867 |
|
* |
|
||
|
Holothuria (Halodeima) grisea Selenka, 1867 c |
|
|
* |
||
|
Phylum: Chordata Clase: Actinopterygii Gymnothorax vicinus Castelnau, 1855 r |
|
|
* |
||
|
Ophichthus sp. r |
|
* |
|
||
|
Abudefduf saxatilis Linnaeus, 1758 c |
* |
* |
* |
||
|
Abudefduf taurus Müller & Troschel, 1848 |
* |
* |
* |
||
|
Bathygobius soporator Valenciennes, 1837 c |
* |
* |
* |
||
|
Canthigaster rostrata Bloch, 1786 r |
|
* |
|
||
|
Chaetodon ocellatus Bloch, 1787 r |
|
* |
|
||
|
Scartella cristata Linnaeus, 1758 c |
* |
* |
* |
||
|
Scorpaena plumieri Bloch, 1789 r |
|
* |
|
||
|
Sparisoma viride Bonnaterre, 1788 r |
|
* |
|
||
|
Stegastes adustus Troschel, 1865 r |
|
* |
* |
||
|
Riqueza |
24 |
89 |
67 |
||
Análisis cuantitativo. Las curvas de acumulación de especies denotan una tendencia a la asíntota, en especial para el intermareal alto y bajo donde la riqueza observada (22 y 53 especies, respectivamente) se aproximó a la predicción de Chao 2 (24 y 56, respectivamente), en estas dos franjas se considera aceptable el esfuerzo de muestreo dado que la representatividad fue de 92% y 94.6%. En cambio, para el intermareal medio la riqueza observada fue de 61 especies, esto equivale un 84.7% de representatividad dado que Chao 2 estimó 72 especies (Fig. 2).

Figura 2. Curvas de especies observadas y estimadas (Chao 2) de las tres franjas intermareales del litoral rocoso Cazones, Veracruz.
Las especies sésiles representaron la mayor parte de la riqueza en todos los sitios y en todos los niveles intermareales. En los intermareales medio y bajo del sitio 3 se registró la mayor riqueza de especies vágiles y sésiles, respectivamente; en cambio, en el intermareal medio en los sitios 1 y 2 se registró la mayor riqueza de especies sésiles (Fig. 3).
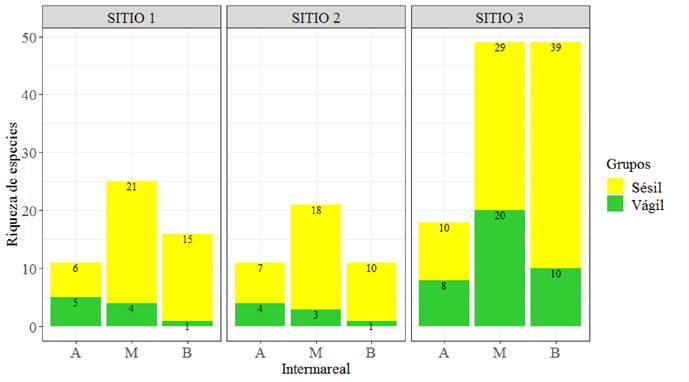
Figura 3. Riqueza de las especies sésiles y vágiles del intermareal alto (A), medio (M) y bajo (B) de los sitios de muestreo en la costa rocosa de Cazones, Veracruz.
En cuanto a la cobertura, ésta no fue uniforme entre los grupos bentónicos y en los sitios del intermareal alto, la cobertura para el sitio 1 estuvo representada por pequeños bivalvos con 31% y por crustáceos (bálanos) con 15%, mientras, para el sitio 2, las coberturas de estos grupos fueron menores con 12.5% y 5.5% respectivamente, mientras, en el sitio 3 los crustáceos (bálanos) prevalecieron con 16.9%, seguido de las macroalgas rojas con 3.5% (Fig. 4).
La cobertura fue más heterogénea en los intermareales medio y bajo, especialmente la mayor contribución fue por pastos marinos representados por Tracheophyta, superando el 50% en los sitios 1 y 2. En segundo lugar, fueron las algas rojas que presentaron coberturas de 13.7% y 14.3% para el intermareal medio y bajo del sitio 1, respectivamente; mientras, en el sitio 2 las algas ocrofitas ocuparon el segundo lugar en cobertura con valores de 3.1% y 9.4% para el intermareal medio y bajo, respectivamente (Fig. 4). Por el contrario, en el intermareal medio del sitio 3 la cobertura estuvo compuesta por algas rodófitas con 29.3%, seguido de clorófitas con 7% y ocrofitas con 6%, mientras, hacia el intermareal bajo, las coberturas de estas macroalgas fueron mayores presentando mayor cobertura algas rodófitas con 46% (Fig. 4).
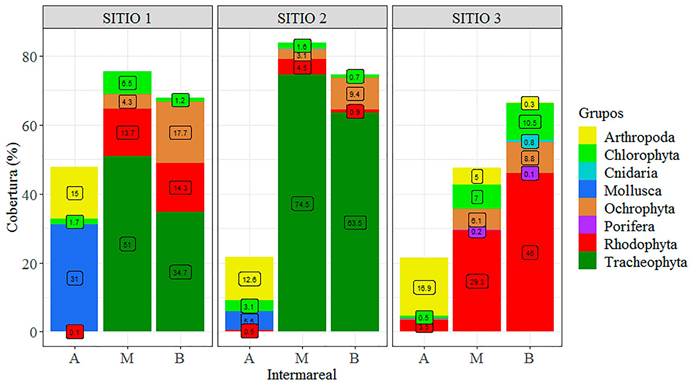
Figura 4. Valores de la cobertura bentónica (%) por sitios y franjas intermareales: alto (A), medio (M), bajo (B) del litoral rocoso de Cazones, Veracruz.
Respecto a la comunidad bentónica vágil, la abundancia fue alta con un total de 30 064 individuos cuantificados en los tres sitios representados por seis grupos vágiles. Comparando a nivel de sitios, la mayor abundancia se registró en el sitio 3 con 19 660 individuos, esto representa el 65%, en comparación al sitio 1 que presentó 2790 individuos (9%). Respecto a las franjas intermareales, la franja alta fue la más cuantiosa con valores de 2684, 7179 y 16 098 individuos para los sitios 1, 2 y 3, respectivamente, y la abundancia decreció hacia las franjas bajas. En esta franja alta, dominaron pequeños moluscos gasterópodos con valores superiores al 99% en los tres sitios (Fig. 5).
Hacia los intermareales medio y bajo, la abundancia de los gasterópodos decreció hasta 0.3%, solo en la franja media del sitio 3 se registró el 47.3%. En estas franjas intermareales, las anémonas fueron las más abundantes, por ejemplo, en la franja baja del sitio 3 se registraron 842 individuos (52.1%), mientras en el intermareal medio y bajo del sitio 2 se obtuvieron valores de 43.5% y 72.1% (130 y 98 individuos, respectivamente); en segundo lugar fueron los equinoideos, en el intermareal bajo del sitio 3 se contabilizaron 618 individuos (38.2%), mientras, en el sitio 1 los valores obtenidos fueron de 43.8% y 100%, pero estos valores equivalen a 28 y 42 equinodermos contabilizados; los crustáceos ocuparon el tercer lugar y la mayor abundancia se registró en intermareal medio del sitio 3, con 38.3% (746 individuos; Fig. 5).
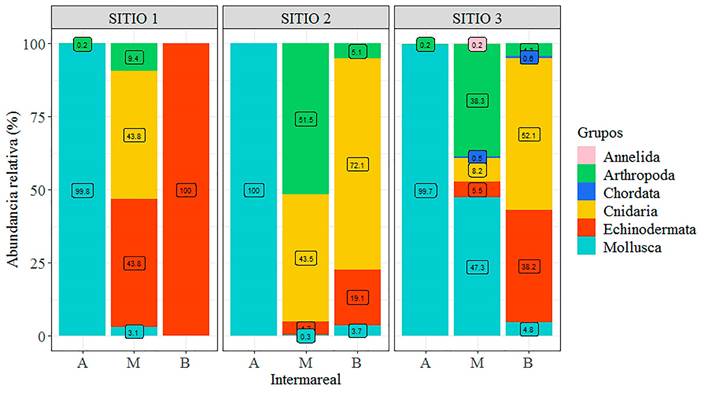
Figura 5. Abundancia relativa de la comunidad vágil por zonas y franjas intermareales: alto (A), medio (M), bajo (B) del litoral rocoso de Cazones, Veracruz.
Con relación a los índices ecológicos, la comunidad bentónica sésil presentó mayor dominancia en el intermareal medio (D= 0.79) y bajo (D= 0.74) del sitio 2, por consiguiente, la diversidad verdadera fue menor en estos lugares (Tabla II), siendo el pasto marino T. testudinum la principal especie que predominó en cobertura (Fig. 6). En el sitio 1 de la franja alta, la dominancia fue de 0.51 y decreció hacia el intermareal bajo con un valor de 0.30, por el contrario, en este lugar la diversidad verdadera se incrementó hacia la franja baja (Tabla II). En la franja alta del sitio 1 las principales especies con mayor cobertura fueron B. exustus y C. fragilis; en cambio, hacia el intermareal medio y bajo la cobertura estuvo representada por T. testudinum y varias especies de rodófitas y ocrofitas, este ensamblaje de especies reafirma la baja dominancia registrada en estos lugares (Fig. 6). Sin embargo, resalta el intermareal medio y bajo del sitio 3, dado que la dominancia fue mínima (D= 0.16 y D= 0.26, respectivamente) y la diversidad verdadera fue muy alta (1D= 12.29 y 1D= 9.48, respectivamente), siendo estos lugares más diversos en especies verdaderas en comparación al resto de los sitios estudiados (Tabla II), y la cobertura estuvo representada especialmente por varias especies de macroalgas las cuales confirman la mínima dominancia en este lugar (Fig. 6).
Por otra parte, la comunidad vágil fue dominante en el intermareal alto de los tres sitios y en el intermareal bajo del sitio 1 y 2, por consiguiente, la diversidad verdadera fue menor en estos lugares (Tabla II). En la franja alta de los tres sitios, E. angustior fue la especie dominante (Fig. 7), mientras, en el intermareal bajo de los sitios 1 y 2 las especies dominantes fueron E. lucunter y A. flosculifera, respectivamente (Fig. 7). Por el contrario, la dominancia fue menor en los tres sitios del intermareal medio y en el sitio 3 de la franja baja, en consecuencia, estos sitios fueron más diversos en especies verdaderas, donde las especies más representativas en abundancia fueron invertebrados (Fig. 7).
Tabla II. Valores de diversidad alfa de la comunidad intermareal sésil y vágil correspondiente a los tres sitios (S1, S2, S3) por intermareal alto (A), medio (M) y bajo (B). Índices de diversidad: Dominancia de Simpson (D), Diversidad verdadera de orden 1 (1D).
|
|
|
|
COMUNIDAD SÉSIL |
|
|
|
|
||
|
Índices ecológicos |
S1-A |
S1-M |
S1-B |
S2-A |
S2-M |
S2-B |
S3-A |
S3-M |
S3-B |
|
D |
0.51 |
0.46 |
0.30 |
0.38 |
0.79 |
0.74 |
0.63 |
0.16 |
0.26 |
|
1D |
2.35 |
4.46 |
5.65 |
3.72 |
1.94 |
1.81 |
2.50 |
12.29 |
9.48 |
|
|
|
|
COMUNIDAD VÁGIL |
|
|
|
|
||
|
Índices ecológicos |
AS1 |
MS1 |
BS1 |
AS2 |
MS2 |
BS2 |
AS3 |
MS3 |
BS3 |
|
D |
0.96 |
0.29 |
1.00 |
0.88 |
0.37 |
0.91 |
0.99 |
0.29 |
0.28 |
|
1D |
1.11 |
4.20 |
1.00 |
1.29 |
3.13 |
1.21 |
1.05 |
4.87 |
4.43 |
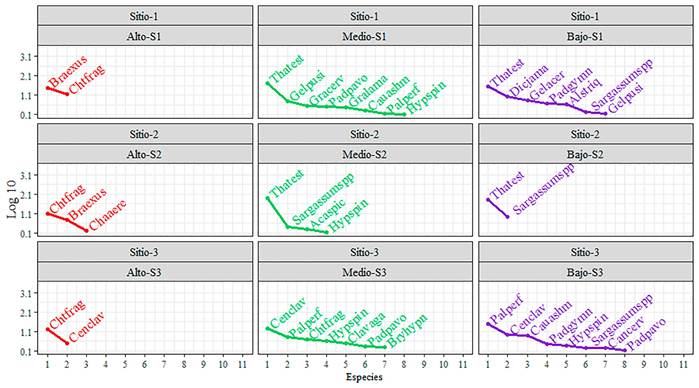
Figura 6. Curva de rango abundancia de las especies sésiles de los tres sitios agrupados por franja intermareal. Los nombres científicos de las especies se muestran en código (las tres primeras letras del género y las cuatro letras de la especie).

Figura 7. Curva de rango abundancia de las especies vágiles de los tres sitios agrupados por franja intermareal. Los nombres científicos de las especies se muestran en código (las tres primeras letras del género y las cuatro letras de la especie).
De acuerdo con el análisis ANOSIM, las comunidades bentónicas registradas en los sitios se consideran homogéneas dado que no se encontraron diferencias significativas (R global= 0.037, p= 0.554); sin embargo, sí se encontraron diferencias significativas entre las franjas intermareales (R global= 0.663, p = 0.029). Sin embargo, con la prueba pareada, las comparaciones resultaron diferentes, pero no significativas entre el intermareal alto y medio (R= 0.8, p= 0.1), así también con el nivel alto y bajo (R= 1, p= 0.1), en cambio, no se encontraron diferencias significativas entre el nivel medio y bajo (R= -0.185, p= 0.7). Con base en el método de ordenamiento NMDS con distancia de Bray-Curtis, la mayor similitud se presentó entre el intermareal alto en los tres sitios (AS1, AS2 y AS3); este grupo se separó con la agrupación del intermareal medio y bajo del sitio 3 (MS3 y BS3), sitio 2 (MS2 y BS2) y sitio 1 (MS1 y BS1), estas dos últimas agrupaciones también fueron distantes y se alejaron más de los primeros dos grupos (Fig. 8).

Figura 8. Análisis de ordenamiento NMDS de la comunidad intermareal del litoral rocoso de Cazones, Veracruz.
DISCUSIÓN
En el área de estudio se registraron al menos 11 filos y se adicionaron 20 nuevos registros, estos resultados obtenidos demuestran la gran relevancia que representa este ecosistema para la biota marina de la región. Con estos datos actualizados la riqueza biológica del intermareal rocoso de Cazones se incrementa de 243 especies reportadas previamente (De la Cruz-Francisco et al., 2017) a 263 especies, se espera continuar añadiendo nuevos registros con el aumento en el esfuerzo de muestreo. También, destacamos los registros de peces juveniles observados en el área de estudio como Gymnothorax vicinus, Abudefduf taurus, Abudefduf saxatilis, Stegastes adustus, Scartella cristata, Chaetodon ocellatus, Canthigaster rostrata y Scorpaena plumieri, especies que son habitantes comunes en los arrecifes coralinos de la región (González-Gándara et al., 2015; Tunnell et al., 2007), este resultado sugiere que debe existir una importante conectividad entre estos ecosistemas, dado que el intermareal rocoso es un ecosistema abierto con un alto dinamismo y conectividad con otros ecosistemas marinos (Cruz-Motta et al., 2010; Lara-Lara et al., 2008; Lubchenco et al., 1991), esto posibilita el asentamiento de especies provenientes de otros lugares extendiendo así su distribución geográfica.
Entre los nuevos registros está Siderastrea stellata, este coral fue reportado por primera vez en el golfo de México para los arrecifes del Sistema Arrecifal Veracruzano (SAV) (ColínGarcía et al., 2017), su distribución original se consideraba endémica de las costas de Brasil (Neves et al., 2008; Tunala et al., 2019), por lo tanto, este presente registro confirma su presencia en Veracruz. Por igual, se destaca el registro de Oculina patagonica, una especie exótica para el golfo de México, reportada inicialmente para el sur de Veracruz (González-Gándara et al., 2015) y se confirmó la presencia de colonias incrustantes en los arrecifes del Sistema Arrecifal Veracruzano (Colín-García et al., 2018); actualmente su distribución se ha extendido hacia la porción norte del este estado, previamente se mencionaba su probable existencia para el área de estudio (De la Cruz-Francisco et al., 2017). Otras nuevas adiciones para la porción norte de Veracruz son Spurilla neapolitana, reportada previamente para el SAV (Zamora-Silva & Ortigosa, 2012) y Phidiana lynceus citada para el litoral de Montepío, Veracruz (Vital et al., 2015) y la costa este de Yucatán (Sanvicente-Añorve et al., 2012).
Si bien estos registros enriquecen el conocimiento de la biodiversidad para el área de estudio, es preciso citar que aún se desconoce la fauna de poliquetos, platelmintos, sipuncúlidos, picnogónidos, crustáceos y urocordados; estos invertebrados son poco conocidos en Veracruz y solamente se han reportado para el intermareal Montepío (Vassallo et al., 2014). También, se requiere un estudio más preciso para identificar las especies de macroalgas, dado que varios táxones se registraron solo a nivel de género. Normalmente para el grupo de las macroalgas se requiere mucho esfuerzo de muestreo y tiempo para su procesamiento en el laboratorio (Gaspar et al., 2017), se espera que próximos estudios incrementen la riqueza macroflorística dado que para el Estado de Veracruz se han registrado 452 especies de macroalgas bentónicas (García-López et al., 2017; González-Reséndiz et al., 2014; Ramírez-Rodríguez & Blanco-Pérez, 2011), por lo que es importante estudiar el epifitismo y la temporalidad, debido a que algunas especies se establecen durante una temporada específica (González-Etchebehere et al., 2017; González-González et al., 1996).
Con relación a las franjas intermareales, el nivel alto se caracterizó por una baja riqueza de especies sésiles y vágiles, este resultado es normal dado que coincide a lo que se reportan para otras regiones (Davidson et al., 2004; Sibaja-Cordero & Cortes, 2010; Zamprogno et al., 2012). La escasa presencia de especies en esta franja intermareal se atribuye a las condiciones ambientales extremas que ocurren constantemente y que se incrementan durante las mareas bajas, esto limita el establecimiento de pocas especies y la comunidad que se desarrolla es dominante, este tipo de estructura ecológica es típica de las costas rocosas tropicales y templadas (Cruz-Motta, 2007; Good, 2004; Jiménez et al., 2004; Londoño-Cruz & Cuellar, 2008; Sousa, 1979a; 1979b; 1984).
Contrariamente, la riqueza de especies fue mayor en los niveles intermareales medio y bajo, resultado que se atribuye a que el estrés físico es menor en estas franjas (Boaventura et al., 2008), además, son cubiertas por pastos marinos (T. testudinum), macroalgas corticadas (e.g., Palisada spp., Acantophora spp., Gracilaria spp., Padina spp., Sargassum spp., Caulerpa spp.) y macroalgas foliosas (Ulva spp.), esta cobertura favorece que especies móviles y sedentarias se refugien para protegerse de la desecación durante las mareas más bajas (Brazeiro et al., 1998; De la Cruz-Francisco et al., 2017; Stephenson & Stephenson, 1949; Villamar & Cruz, 2007). También, se atribuye a la presencia de pozas de marea ya que proveen espacios para la biota marina (De la Cruz-Francisco et al., 2017; González-Solís et al., 2017; Saavedra-Sotelo, 2012), por ende, dichas franjas intermareales se caracterizan por resguardar mayor diversidad de macroalgas, invertebrados y cordados (Bertocci et al., 2010; Londoño-Cruz et al., 2014; Salazar-Vallejo & González, 1990; Sibaja-Cordero & Vargas-Zamora, 2006).
Al igual que la riqueza de especies, la cobertura bentónica también fue menor en el nivel superior del intermareal representados por pequeños balanos (C. fragilis) y bivalvos (B. exustus). Estos resultados son similares al ensamblaje de géneros (Brachiodontes y Chthamalus) que se reportan para otras localidades (Boaventura et al., 2008; Yoo, 2003; Zamprogno et al., 2012). Así también, el 99% de la abundancia de la comunidad vágil estuvo representada principalmente por pequeños litorínidos (E. angustior). Estas especies representativas en cobertura (balanos y bivalvos) y abundancia (gasterópodos) constituyen una comunidad dominante en el intermareal alto, misma que coincide con la zonación típica que ha sido descrita para las costas rocosas (Boaventura et al., 2008; Londoño-Cruz & Cuéllar, 2008; Spight, 1978; Zamprogno et al., 2012).
Hacia el intermareal medio y bajo, la cobertura por organismos sésiles fue mayor principalmente por flora marina, sin embargo, no fue homogénea entre los sitios de muestreo, dado que en el sitio 3 la cobertura estuvo representada principalmente por macroalgas. Este predominio en el nivel bajo parece ser común ya que se ha reportado en otros estudios (Good, 2004), la estructura comunitaria presentó mayor diversidad y baja dominancia, principalmente las rodófitas contribuyeron con mayor cobertura en el nivel bajo, parte de esta comunidad de macroalgas registrada coincide con lo que se reporta para otras localidades (Gaspar et al., 2017; Yoo, 2003). Mientras, en el nivel medio y bajo del sitio 1 y 2 fue dominante la comunidad sésil, ya que el pasto marino T. testudinum fue la especie que presentó mayor cobertura, aunque decreció hacia el nivel bajo, esto puede atribuirse a las características de la pendiente, ya que tiene mayor inclinación y el sustrato cambia por un fondo arenoso con restos de conchas y cantos rodados; además, la fuerza del oleaje es mayor y constante, causando el depósito de arena y restos de conchas hacia el margen del intermareal bajo.
Si bien los pastos marinos dominaron en cobertura en los niveles medio y bajo de los sitios 1 y 2, varias especies de rodófitas y ocrofitas también se encontraron en el intermareal cohabitando con los pastos marinos. Principalmente, se registraron macroalgas de los géneros Dictyota, Gelidium, Gracilaria, Hypnea, Palisada y Sargasum las cuales están adaptadas al embate del oleaje, dicho ensamblaje de macroalgas también se ha observado en otras regiones costeras (Camus & Andrade, 1999; Gaspar et al., 2017; Yoo, 2003).
Respecto a la comunidad vágil, la abundancia fue menor en el intermareal medio y bajo (pero presentó mayor riqueza de especies) en comparación la franja alta que presentó mayor abundancia (y poca riqueza), este contraste también se ha reportado en otro estudio (Davidson et al., 2004). Además, la abundancia relativa no fue homogénea entre los tres sitios de muestreo, lo cual parece estar relacionado con la dominancia en cobertura de T. testudinum. En el intermareal medio del sitio 1, la cobertura por pastos fue de 51%, aquí las abundancias de anémonas (representado por A. flosculifera) y erizos (representado por E. lucunter) fueron parecidas, pero hacia el nivel bajo, la cobertura de T. testudinum decreció a 34.7% y la abundancia de erizos aumentó, pero las anémonas se ausentaron. Contrariamente, en el sitio 2, la cobertura de T. testudinum en el intermareal medio y bajo (74.5% y 63.5% respectivamente) coincide con la notable abundancia de anémonas y con la mínima abundancia de erizos, estos resultados parecen sugerir que las coberturas de pastos marinos favorecen la abundancia de anémonas, pero parece limitar la abundancia de erizos.
La dominancia en la comunidad vágil se presentó principalmente en el intermareal bajo del sitio 1 (caracterizado por menor cobertura de pastos marinos), la cual se atribuye a la abundancia del erizo E. lucunter, esta especie es común y abundante en los ambientes someros, por ejemplo, en los arrecifes coralinos de la región es el más abundante de los equinodermos y tiene preferencia por habitar en zonas cubiertas de algas (Morales-Quijano et al., 2017). Mientras en el nivel bajo del sitio 2 caracterizado por mayor cobertura de T. testudinum, la dominancia de la comunidad vágil se atribuye a la abundancia de A. flosculifera, esta anémona se caracteriza por habitar en áreas someras cubiertas por pastos marinos adherida a sustratos duros o enterrados en la arena y también tiene distribución en los arrecifes coralinos de la región (De la Cruz-Francisco & González-Muñoz, 2019; González-Muñoz et al., 2012).
Mientras, en el sitio 3, la comunidad vágil presentó baja dominancia en el intermareal medio y bajo, en este lugar la roca sedimentaria presenta una pendiente suave y termina en el borde del intermareal bajo en una columna vertical y está cubierto principalmente por macroalgas que son resistentes a la desecación y al embate del oleaje (Holloway-Adkins & Hanisak, 2015; Sibaja-Cordero & Cortes, 2010). La baja dominancia y mayor diversidad de especies en este lugar puede estar relacionada con la notable cobertura de macroalgas, ya que las frondas y talos proveen refugio y alimentación para la fauna vágil; además, la presencia de pozas de marea en este sitio podría favorecer una mayor riqueza de especies ya que estos espacios proveen microhábitats para el establecimiento de varios grupos taxonómicos que incluyen especies de algas, anémonas, crustáceos, gasterópodos, erizos y peces (Martins et al., 2007; SaavedraSotelo, 2002; Torruco et al., 2012).
Por otra parte, los análisis multivariados evidencian que la comunidad del intermareal alto fue distinta a los niveles medio y bajo, ya que en el nivel alto se estableció una comunidad caracterizada por una baja riqueza y cobertura de especies sésiles representada por balanos y bivalvos, y por la dominancia de pequeños organismos vágiles representados por gasterópodos (litorínidos), esta estructura comunitaria es común en todas las costas rocosas (Boaventura et al., 2002; Good et al., 2004; Londoño-Cruz & Cuéllar, 2008; Zamprogno et al., 2012). En el intermareal medio y bajo del sitio 3 se distingue otra comunidad caracterizada por presentar mayor diversidad de especies y ser equitativa, el sustrato estuvo cubierto principalmente por macroalgas; mientras la abundancia de la comunidad vágil también fue equitativa, la heterogeneidad de esta comunidad parece estar relacionada a la notable cobertura de macroalgas y a la topografía del sustrato por la presencia de pozas de marea las cuales proveen microhábitats (Good et al., 2004), favoreciendo una mayor riqueza de especies de distintos grupos taxonómicos. Otro grupo afín fue el intermareal medio y bajo del sitio 1, en estos lugares la comunidad sésil presentó poca dominancia y se caracterizó por la cobertura de pastos marinos y macroalgas; en cambio, la comunidad vágil fue dominante por la prevalencia de E. lucunter. Mientras, la comunidad establecida en el nivel medio y bajo del sitio 2 se distinguió por la dominancia de la comunidad sésil representado por T. testudinum y por la dominancia de la comunidad vágil atribuido por la abundancia de A. flosculifera.
Finalmente, se destaca que el intermareal rocoso de Cazones es un ecosistema heterogéneo y diverso en especies caracterizado por la cobertura de macroalgas y pastos marinos, que, junto con las pozas de marea, proveen refugio, protección y alimentación para múltiples especies marinas, incluyendo especies arrecifales que encuentran recursos alimenticios y protección en el intermareal. Sin embargo, algunos hábitats que son relevantes para la biota marina como los pastos marinos pueden ser vulnerables ante las perturbaciones de origen humano. Por estas razones, consideramos que es un sitio prioritario para plantear medidas de manejo y protección a fin de salvaguardar la biota marina y los servicios ecosistémicos que proporciona para la línea costera.
AGRADECIMIENTOS
Los autores
agradecen a Coral Kaztenny López Torres, Aarón Durán López, Gabriel Omar
Ramos Téllez y Ramses Giovanni León-Méndez, por el apoyo brindado en el trabajo
de campo.
REFERENCIAS
Álvarez, N., Villalobos, J. L. & Cházaro-Olvera, S. (2011). Camarones y cangrejos dulceacuícolas y marinos (Crustacea: Decapoda). En A. Cruz-Angón (Ed.), La biodiversidad en Veracruz: Estudio de Estado (pp. 287–292). Comisión Nacional para el Conocimiento y Uso de la Biodiversidad. México.
Benedetti-Cecchi, L., Rindi, F., Bertocci, I., Bulleri, F. & Cinelli, F. (2001). Spatial variation in development of epibenthic assemblages in a coastal lagoon. Estuarine, Coastal and Shelf Science, 52, 659–668. https://doi.org/10.1006/ecss.2001.0775
Bertocci, I., Maggi, E., Vaselli, S. & Benedetti-Cecchi, L. (2010). Resistance of rocky shore assemblages of algae and invertebrates to changes in intensity and temporal variability of aerial exposure. Marine Ecology Progress Series, 400, 75–86.
Boaventura D., Cancela da Fonseca, P. Ré, L. & Hawkins, S. J. (2008). Intertidal rocky shore communities of the continental portuguese coast: Analysis of distribution patterns. Marine Ecology, 23(1), 69–90. https://doi.org/10.1046/j.1439-0485.2002.02758.x
Brazeiro, A., Rozbaczylo, N. & Fariña, J. M. (1998). Distribución espacial de la macrofauna en una playa expuesta de Chile central: efectos de la morfodinámica intermareal. Investigaciones Marinas Valparaíso, 26, 119–126. http://dx.doi.org/10.4067/S0717-71781998002600011
Camus, P. A. & Andrade, Y. N. (1999). Diversidad de comunidades intermareales rocosas del norte de chile y el efecto potencial de la surgencia costera. Revista Chilena de Historia Natural, 72, 389–410.
Clarke, K. R. & Gorley, R. N. (2001). Primer v5: User Manual/Tutorial. Primer-E.
Colín-García, N. A., Campos, J. E., Tello-Musi, J. L., Forsman, Z. H., Montero-Muñoz, J. L., Monsalvo-Reyes, A. & Arias-González, J. E. (2017). Comparative molecular and morphological variation analysis of Siderastrea (Anthozoa, Scleractinia) reveals the presence of Siderastrea stellata in the Gulf of Mexico. The Biological Bulletin, 232(1), 58–70. https://doi.org/10.1086/691788
Colín-García, N. A., Campos, J. E., Tello-Musi, J. L., Pérez-España, H. & Carrara, X. C. (2018). First record of the invasive coral Oculina patagonica (Cnidaria, Scleractinian) in the Gulf of Mexico. Check List, 14(4), 613–617. https://doi.org/10.15560/14.4.613
Correa-Sandoval, A. & Rodríguez-Castro, J. H. (2013). Zoogeografía de los bivalvos marinos de la costa de Tamaulipas, México. Revista de Biología Marina y Oceanografía, 48(3), 565–584. http://dx.doi.org/10.4067/S0718-19572013000300013
Cruz-Motta, J. J., Miloslavich, P., Palomo, G., Iken, K., Konar, B., Pohle, G., Trott, T.,
Benedetti-Cecchi, Herrera, C., Hernández, A., Sardi, A., Bueno, A., Castillo, J., Klein, E., Guerra-Castro, E., Gobin, J., Gómez, D. I., Riosmena-Rodríguez, R., Mead, A., Bigatti, G., Knowlton A. & Shirayama, Y. (2010). Patterns of Spatial Variation of Assemblages Associated with Intertidal Rocky Shores: A Global Perspective. PLoS ONE, 5(12), e14354. https://doi.org/10.1371/journal.pone.0014354
Cruz-Motta, J. J. (2007). Análisis espacial de las comunidades intermareales asociadas a los litorales rocosos de Venezuela. Ciencias Marinas, 33(2), 133–148.
Davidson, I. C., Crook, A. C. & Barnes, D. K. A. (2004). Quantifying spatial patterns of intertidal biodiversity: is movement important? Marine Ecology, 25(1), 15–34. https://doi.
org/10.1111/j.1439-0485.2004.00015.x
De la Cruz-Francisco, V., Orduña-Medrano, R. E., Paredes- Flores, J. E., Vázquez-Estrada, R. I., González-González, M. & Flores-Galicia, L. (2017). Una aproximación a la florística y faunística de la costa rocosa El Pulpo, Cazones, Veracruz, México. CICIMAR Oceánides, 32(1), 39–58. https://doi.org/10.37543/oceanides.v32i1.195
De la Cruz-Francisco, V. & González-Muñoz, R. (2019). Las anémonas marinas de los Sistemas Arrecifales del Suroeste del golfo de México. En A. Granados-Barba, L. Ortiz-Lozano, C. González-Gándara, C. & D. Salas-Monreal (Eds.). Estudios científicos en el Corredor Arrecifal del Suroeste del Golfo de México (pp. 139–156). Universidad Autónoma de Campeche.
Dreckmann, E. K. & Sentíes, A. (2009). Gracilaria, subgénero Textoriella (Gracilariaceae, Rhodophyta) en el golfo de México y el Caribe mexicano. Revista Mexicana de Biodiversidad, 80, 593–601. https://doi.org/10.22201/ib.20078706e.2009.003.154
Dreckmann, E. K. (2009). Flora Monográfica de los géneros Gracilaria Greville e Hydropuntia Montagne (Gracilariaceae, Rhodophyta) en las costas mexicanas del Golfo de México y Caribe mexicano. [Tesis de doctorado. Universidad Autónoma Metropolitana].
Foster, M. S., Nigg, E. W., Kiguchi, L. M., Hardin, D. D. & Pearse, J. S. (2003). Temporal variation and succession in an algal-dominated intertidal assemblage. Journal of Experimental Marine Biology and Ecology, 289, 15–39.
García-Cubas, A. & Reguero, M. (2004). Catálogo ilustrado de moluscos gasterópodos del golfo de México y Mar Caribe (Primera Edición). Instituto de Ciencias del Mar y Limnología.
García-López, D. Y., Mateo-Cid, L. E. & Mendoza-González, A. C. (2017). Nuevos registros y lista actualizada de las algas verdes (Chlorophyta) del litoral de Veracruz, México. Gayana Botanica, 74(1), 41–56. http://dx.doi.org/10.4067/S0717-66432017005000104
Gaspar, R., Pereira, L. & Neto, J. M. (2017). Intertidal zonation and latitudinal gradients on macroalgal assemblages: species, functional groups and thallus morphology approaches. Ecological Indicators, 81, 90–103. https://doi.org/10.1016/j.ecolind.2017.05.060
Gómez, P. (2007). Inventario de las esponjas del Parque Nacional Sistema Arrecifal Veracruzano con nuevos registros de especies (Porifera: Demospongiae). En Granados-Barba, A., Abarca-Arenas, L. & Vargas-Hernández, J. M. (Eds). Investigaciones científicas en el Sistema Arrecifal Veracruzano (pp. 51–72). Universidad Autónoma de Campeche.
González, J. I. (2011). Predicción de mareas de México. MAR V1.0. Disponible en: http:// predmar.cicese.mx/programa/
González-Etchebehere L., Kurk, C., Scarabino, F., Laporta, M., Zabaleta, M., González, L. & Vélez-Rubio, G. (2017). Comunidades de macroalgas en puntas rocosas de la costa de Rocha, Uruguay. INNOTEC, 14, 17–30. https://doi.org/10.26461/14.07
González-Gándara, C., Domínguez-Barradas, C., De la Cruz-Francisco, V., Solís-Marín, F. A. & Carricart-Ganivet, J. P. (2015). Esponjas, corales escleractinios, equinodermos y peces de arrecifes coralinos del norte y sur de Veracruz, México (informe técnico). SNIB-CONABIO.
González-González, J., Gold-Morgan, M., León-Tejera, H., Candelaria, C., León-Álvarez, D., Serviere-Zaragoza, E. & Fragoso, D. (1996). Catálogo onomástico (nomenclátor) y bibliografía indexada de las algas bentónicas marinas de México. Cuadernos del Instituto de Biología. UNAM, 29, 9–491.
González-Muñoz, R., Simoes, N., Sánchez-Rodríguez, J., Rodríguez, E. & Segura-Puertas, L. (2012). First inventory of sea anemones (Cnidaria: Actiniaria) of the Mexican Caribbean. Zootaxa, 3556, 1–38. https://doi.org/10.11646/zootaxa.3556.1.1
González-Muñoz, R., Simoes, N., Tello-Musi, J. L. & Rodríguez, E. (2013). Sea anemones (Cnidaria, Anthozoa, Actiniaria) from coral reefs in the southern Gulf of Mexico. Zookeys, 341, 77–106. https://doi.org/10.3897/zookeys.341.5816
González-Reséndiz, M. L., García-Sánchez, L. M., Rodríguez-Juárez, J. G., De Gyves-López, J. S. & León-Tejera, H. (2014). Caracterización de ambientes algales en Playa Muñecos, Veracruz, México. Investigación Universitaria Multidisciplinaria, 13(13), 36–42.
González-Solís, A., Torruco, D., Torruco-González, A. D. & Ordaz-Bencomo, J. F. (2017). Ambientes extremos amenazados: las costas rocosas. Biodiversitas, 130, 7–11.
Good, T. P. (2004). Distribution and abundance patterns in Caribbean rocky intertidal zones. Bulletin of Marine Science, 74(2), 459–468.
Hajdu, E. & Teixeira, J. N. (2011). New or Little demosponges (Porifera) from Espírito Santo coast and seamounts (Brazil). Zoologia, 28(2), 233–246. https://doi.org/10.1590/S198446702011000200013
Hammer, O., Harper, D. A. T. & Ryan, P. D. (2001). PAST: Palaentological Statisticts Software Package for Education and Data Analysis. Palaeontología Electrónica, 4(1), 9–19.
Holloway-Adkins, K. G. & Hanisak, M. D. (2015). Macroalgal community within a warm temperature/subtropical biogeographic transition zone in the western Atlantic Ocean. Bulletin of Marine Science, 91(3), 295–319. https://doi.org/10.5343/bms.2014.1008
Humann, P. & Deloach, N. (2002). Reef Fish Identification, Florida, Caribbean, Bahamas (3ra edición). New World Publication.
Jiménez, P. M., Brightdoom, M. & Díaz, O. (2004). Moluscos del litoral rocoso en cuatro localidades del Estado Sucre, Venezuela. Saber, Universidad de Oriente, Venezuela, 16(1), 9–18.
Kaiser, M. J., Attrill, M. J., Jennings, A., Thomas, D. N., Barnes, D. K. A., Brierley, A. S., Hiddink, J. G., Kaartokallio, H., Polunin, N. V. C. & Raffaelli, D. G. (2011). Marine ecology: processes, systems, and impacts (Second edition). Oxford University Press.
Landa-Cansigno, C., Mateo-Cid, L. E., Mendoza-González, A. C. & Guerrero-Analco, J. A. (2019). Macroalgas marinas del litoral rocoso Neovolcánico de Veracruz, México. Acta Botánica Mexicana, 126, e1525. https://doi.org/10.21829/abm126.2019.1525
Lara-Lara, J. R., Arreola Lizárraga, J. A., Calderón-Aguilera, L. E., Camacho, V. F., Espino,
G. L., Escofet-Giansone, A., Espejel, M., Guzmán, M., Ladah, L., López, M., Meling, E., Moreno-Casasola, P., Reyes-Bonilla, H., Ríos-Jara, E. & Zertuche, J. A. (2008). Los ecosistemas costeros, insulares y epicontinentales. En J. Soberón, G. Halffter & J. Llorente (Eds.), Capital natural de México, vol. I: Conocimiento actual de la biodiversidad (pp. 109–134). CONABIO.
León, A. D., Candelaria, S. C., Hernández, A. P. & León, T. H. (2007). Géneros de algas marinas tropicales de México. I. Algas verdes (Primera edición). Universidad Nacional Autónoma de México.
Littler, D. S. & Littler, M. M. (2000). Caribbean reef plants. An identification guide to the reef plants of the Caribbean, Bahamas, Florida and Gulf of Mexico. OffShore Graphics, Inc.
Londoño-Cruz, E., López de Mesa-Agudelo, L. A., Arias-Galvez, F., Herrera-Paz, D. L., Prado, A., Cuellar, L. M. & Cantera, J. (2014). Distribution of macroinvertebrates on intertidal rocky shores in Gorgona Island, Colombia (Tropical Eastern Pacific). Revista de Biología Tropical, 26, 189–198.
Londoño-Cruz, E. & Cuellar, J. L. (2008). Fauna asociada a zonas rocosas intermareales en las localidades de Piñas y Cabo Marzo (Chocó), zona norte de la costa pacífica colombiana. En: Valencia, B., & Giraldo, A. (Eds.). Caracterización ecológica de los arrecifes coralinos y bosques de manglar en Cabo Marzo, zona norte del litoral Pacífico colombiano: estructura, composición, diversidad y fauna asociada, Informe Técnico Final (pp. 164–179). Convenio de Cooperación Conservación International Foundation-Universidad del Valle. Cali, Colombia.
Lubchenco, J., Olson, A. M., Brubaker, L. B., Carpenter, S. R., Holland, M. M., Hubbell, S. P., Levin, S. A., Macmahon, J. A., Matson, P. A., Melillo, J. M., Mooney, H. A., Peterson, C. H., Pulliam, H. R., Real, L. A., Regal, P. J. & Risser, P. G. (1991). The Sustainable Biosphere Initiative: An Ecological Research Agenda. Ecology, 72, 371–412. https://doi.org/10.2307/2937183
Martins, G. M., Hawkins, S. J., Thompson, R. C. & Jenkins, S. R. (2007). Community structure and functioning in intertidal rock pools: effects of pool size and shore height at different successionl stages. Marine Ecology Progress Series, 329, 43–55.
Méndez, U. M., Sous, W. V. & Carranza, E. A. (1985). La importancia de la granulometría en la distribución de organismos bentónicos. Estudio de playas del estado de Veracruz, México.
Contribución de la UNAM, 457, 45–56.
Morales-Quijano, I., De la Cruz-Francisco, V., González-González, M. & Argüelles-Jiménez, J. (2017). Diversidad y abundancia de los equinodermos y su relación con la cobertura bentónica del arrecife Enmedio, Sistema Arrecifal Lobos-Tuxpan, México. Revista Ciencias Marinas y Costeras, 9(2), 51–74. http://dx.doi.org/10.15359/revmar.9-2.3
Moreno, C. & Halffter, G. (2000). Assesing the completeness of bat biodiversity inventories using species accumulation curves. Journal of Applied Ecology, 37, 149–158.
Moscoso, V. (2013). Clave para identificación de crustáceos decápodos y estomatópodos del Perú. Boletín: Instituto del Mar del Perú, 28(1–2), 8–135.
Neves, E. G., Andrade, S. C., da Silveira, F. L. & Solferini, V. N. (2008). Genetic variation and population structuring in two brooding coral species (Siderastrea stellata and Siderastrea radians) from Brazil. Genetica, 132(3), 243–254. https://doi.org/10.1007/s10709-0079168-z
Ortigosa, D. & Simones, N. (2019). Sea slugs (Gastropoda: Heterobranchia) from two remote reefs of the Southern Gulf of Mexico: Cayo Arenas and Cayo Arcas. Revista Mexicana de Biodiversidad, 90, 1–12. https://doi.org/10.22201/ib.20078706e.2019.90.2596
Ortiz-García, A. E., Ramírez-Fernández, M. A. & Montano Rivas, J. A. (2006). Estudio de la ictiofauna de la zona intermareal rocosa de playa paraíso, perteneciente al estado de Veracruz. Comunicación Científica IV Congreso Iberoamericano Virtual de Acuicultura, 801–812.
Quirós, R. J. & Hernando, N. C. (2013). Moluscos asociados a ensamblajes macroalgales en el litoral rocoso de Córdoba, Caribe Colombiano. Boletín de Investigaciones Marinas y Costeras, 42(1), 101–120.
Ramírez-Rodríguez, A. & Blanco-Pérez, R. (2011). Macroalgas bentónicas marinas: conocimiento actual. En Comisión Nacional para el Conocimiento y Uso de la Biodiversidad. La Biodiversidad en Veracruz, Estudio de Estado (pp. 51–57). Comisión Nacional para el Conocimiento y Uso de la Biodiversidad (CONABIO), Gobierno del Estado de Veracruz, Universidad Veracruzana, Instituto de Ecología, A.C. Xalapa, México.
R Core Team (2021). R: A language and environment for statistical computing. R Foundation for Statistical Computing, Vienna, Austria. https://www.R-project.org/
Saavedra-Sotelo, N. C. (2002). Valoración de las pozas de marea como microhábitat de la infauna béntica en el Alto Golfo de California, México. [Tesis de licenciatura. Universidad Autónoma del Estado de Morelos].
Salazar-Vallejo, S. I. & González, N. E. (1990). Ecología costera en la región de la Mancha, Veracruz. La Ciencia y el Hombre, 6, 101–120.
Sanvicente-Añorve, L., Hermoso-Salazar, M., Ortigosa, J., Solís-Weiss, V., & Lemus-Santana, E. (2012). Opisthobranch assemblages from a coral reef system: The role of habitat type and food availability. Bulletin of Marine Science, 88, 1061–1074. https://doi.org/10.5343/ bms.2011.1117
Sibaja-Cordero, J. A. & Cortés, J. (2010). Comparación temporal de la composición y zonación de organismos en el intermareal rocoso del Parque Nacional Isla del Coco, Pacífico de Costa Rica. Revista de Biología Tropical, 58(4), 1387–1403.
Sibaja-Cordero, J. A. & Vargas-Zamora, J. A. (2006). Zonación vertical de epifauna y algas en litorales rocosos del Golfo de Nicoya, Costa Rica. Revista de Biología Tropical, 54, 49–67.
Sousa, W. P. (1979a). Experimental investigations of disturbance and ecological succession in a rocky intertidal algal community. Ecological Monographs, 49, 227–254.
Sousa, W. P. (1979b). Disturbance in marine intertidal Boulder fields: the nonequilibrium maintenance of species diversity. Ecology, 60, 1225–1239.
Sousa, W. P. (1984). Intertidal mosaics: patch size, propagule availability, and spatially variable patterns of succession. Ecology, 65, 1918–1935.
Spight, T. M. (1978). Temporal changes in a tropical rocky shore snail community. Veliger, 21, 131–143.
Stephenson, A. & Stephenson, T. A. (1949). The universial features of zonation between the tide-marks on rocky coasts. Journal of Ecology, 37, 289–305.
Torruco, D., González, A., Ruiz, L., Tonatiuh-Reyes, D. & Torruco, A. D. (2012). Pozas de Marea: un hábitat extremo en un ambiente extremo. CONABIO. Biodiversitas, 104, 12–16.
Tunala, L. P., Tâmega, F. T. S., Duarte, H. M. & Couthino, R. (2019). Stress factors in the photobiology of the reef coral Siderastrea stellata. Journal of Experimental Marine Biology and Ecology, 518, 151188. https://doi.org/10.1016/j.jembe.2019.151188
Tunnell, Jr. J. W., Chávez, E. A., Whiter, K., Barrera, N., Beaver, C. R., Davidson, J., Gourley, J. E., Moretzsonhn, F., James, S. N., Pearce, J. J. & Vega, M. E. (2007). Checkist of the Biota Associated with Southern Gulf of México Corla Reefs and Coral Reef Islands. Gulf Base (Online database at www.gulfbase.org). Harte Research institute for Gulf of Mexico Studies, Texas AyM University- Corpus Christi. Corpus Christi, Texas.
Vargas-Hernández, J. M. & Ramírez-Rodríguez, A. (2006). Los arrecifes rocosos. En MorenoCasasola, P. (Ed.). Entornos Veracruzanos: La costa de la Mancha (pp. 381–407). Instituto de Ecología, A.C., Xalapa, Veracruz.
Vassallo, A., Dávila, Y., Luviano, N., Deben, A. M., Vital, X. G., Conejeros, A. C., Vázquez, L. & Álvarez, F. (2014). Inventario de invertebrados de la zona rocosa intermareal de Montepío, Veracruz, México. Revista Mexicana de Biodiversidad, 85, 349–362. https://doi.org/10.7550/rmb.42628
Vilchis, A. M. I. (2015). Biogeografía de las grandes macroalgas en el golfo de México y Caribe Mexicano. [Tesis de maestría. Universidad Autónoma Metropolitana].
Villamar, F. & Cruz, M. (2007). Macrofauna bentónica en la zona intermareal y submareal en caleta Aeolian, isla Baltra (Galápagos, Ecuador). Acta Oceanográfica del Pacifico, 14(1), 139–145.
Vital, X. G., Álvarez, F. & Ortigosa, D. (2015). Nuevos registros de nudibranquios (Gastropoda: Nudipleura) en Veracruz, México. Revista Mexicana de Biodiversidad, 86, 528–530.
https://doi.org/10.1016/j.rmb.2015.04.030
Wickham, H. (2016). ggplot2: Elegant Graphics for Data Analysis. Springer-Verlag New York. ISBN 978-3-319-24277-4. https://ggplot2.tidyverse.org.
Yoo, J. S. (2003). Biodiversity and community structure of marine benthic organisms in the rocky shore of Dongbaekseom, Busan. Algae, 18(3), 225–232.
Zamora-Silva, A. & Ortigosa, D. (2012). Nuevos registros de opistobranquios en el Parque Nacional Sistema Arrecifal Veracruzano, México. Revista Mexicana de Biodiversidad, 83, 359–369.
Zamora-Silva, A. & Naranjo-García, E. (2008). Los opistobranquios de la Colección Nacional de Moluscos. Revista Mexicana de Biodiversidad, 79, 333–342.
Zamprogno, G. C., Fernandes, F. C. & Fernandes, L. L. (2012). Temporal and spatial variation of rocky shores intertidal benthic communities in southeast Brazil. Iheringia, Série Zoologia, 102(4), 375–383. https://doi.org/10.1590/S0073-47212012000400003
Cómo citar: Rodríguez-Muñoz, S., Granados-Vargas, N. & De la Cruz-Francisco, V. (2023). Análisis de la comunidad vágil y sésil del intermareal rocoso de cazones, Veracruz, México. Novitates Caribaea, (22), 25–50. https://doi.org/10.33800/nc.vi22.337