INTRODUCCIÓN
Las islas son un escenario ideal para estudios ecológicos y evolutivos. Sus poblaciones, comunidades y ecosistemas, son entidades con límites geográficos bien definidos donde se desarrollan los procesos, propiedades e interacciones fundamentales de los sistemas ecológicos; aunque a menudo de manera más simple que los sistemas continentales (Vitousek et al., 1995). El equilibrio de estos ecosistemas es relativamente frágil y su conservación depende del conocimiento de la composición de especies y de la gama de aspectos ecológicos de los que dependen (Rocha et al., 2002).
Sobre la fauna de reptiles del archipiélago de los Jardines de la Reina se han realizado reportes de especies que incluyen sus características morfológicas y de hábitat (Marichal, 2016a; Parada et al., 2007; Rodríguez y Rivalta, 2003; Schwartz y Henderson, 1991). Sin embargo, son muy pocos los estudios ecológicos realizados sobre las comunidades o poblaciones (González et al., 2014; Marichal, 2016b; Marichal y López, 2012). El conocimiento sobre la herpetofauna de esta cayería es aún insuficiente para comprender la estructura de las comunidades de reptiles y su función en los ecosistemas insulares.
OBJETIVO
-Actualizar el inventario de reptiles y evaluar la abundancia y dinámica de la comunidad de lagartos terrestres diurnos en varios cayos del archipiélago de los Jardines de la Reina.
MATERIALES Y MÉTODOS
Área de estudio. El archipiélago de los Jardines de la Reina se extiende desde el Golfo de Guacanayabo hasta la Bahía de Casilda en la parte meridional de la Isla de Cuba, por la costa sur de las provincias Sancti Spíritus, Ciego de Ávila y Camagüey a lo largo de 360 km. Agrupa 661 cayos, los que conforman tres cayerías, la que forma el Laberinto de las Doce Leguas y otras dos en el interior del golfo de Ana María.
El estudio fue realizado en los cayos Cabeza del Este, Caguamas, Cachiboca, Piedra Grande, Anclitas, Caballones, Grande y Casimba, que siguen la dirección de este a oeste en la cayería del Laberinto de las Doce Leguas (Fig. 1). Según González-de Zayas et al. (2006) estos cayos se caracterizan por tener unidades de paisaje de poco desarrollo evolutivo, extensión relativamente pequeña y gran fragilidad natural, por estar sometidas a condiciones físico-geográficas extremas tales como fuertes vientos, marejadas, alta evaporación, salinización y sequedad estacional.
Las formaciones vegetales presentes en el área son: los bosques de mangles en sus diferentes variantes florísticas y fisionómicas, los matorrales xeromorfos costeros, los complejos de vegetación de costa arenosa y rocosa, bosque siempreverde, herbazal costero y vegetación halófita (Martínez, 2020).
Área de estudio
 Figura 1. Mapa de los sitios de muestreo de reptiles en el archipiélago de los Jardines de la Reina, Cuba.
Figura 1. Mapa de los sitios de muestreo de reptiles en el archipiélago de los Jardines de la Reina, Cuba.
Metodología de muestreo. Los muestreos fueron realizados en noviembre de 2017 y abril y mayo de 2018. El inventario de especies se realizó en los ocho cayos antes mencionados. (Fig. 1). Debido a la heterogeneidad morfológica, conductual y ecológica de los reptiles, se realizaron recorridos aleatorios en el área, transectos en banda y búsqueda en diferentes microhábitats para maximizar la riqueza de especies observada según proponen Torres et al. (2017). La abundancia relativa se determinó como cantidad de individuos en 800 m1 a partir de transectos en banda (200 m x 4 m), (Arias, 2009). Con el objetivo de comparar con muestreos previos de C. nubila nubila en el área de estudio y en toda Cuba, se realizaron transectos de (1000 x 10) m según el protocolo establecido para el monitoreo de esta especie en la región de archipiélagos del Sur de Cuba (González et al., 2013).
Todos los transectos fueron realizados en el Matorral Xeromorfo Costero (Fig. 2). Esta formación vegetal ocupa una franja arenosa estrecha que se entiende a lo largo de la costa sur de los cayos. La cantidad de transectos realizados fue variable de acuerdo al área de matorral de cada cayo. En cayo Cabeza del Este esta formación vegetal está ausente y en Casimba posee poca extensión por lo que el muestreo de la abundancia se realizó en seis de los cayos (Grande, Caballones, Anclitas, Cachiboca, Piedra Grande y Caguamas).

Figura 2. Matorral Xeromorfo Costero con predominio de Coccothrinax litoralis Leon, en Cayo Cachiboca, archipiélago de los Jardines de la Reina, Cuba, septiembre de 2018.
Los conteos se realizaron entre las 9:00 y las 13:00 horas, correspondiente al periodo de mayor actividad de reptiles diurnos (Torres et al., 2017). En el caso de C. nubila, especie que constituye el principal objeto de conservación de la fauna terrestre del Parque Nacional Jardines de la Reina, se determinó las proporciones de hembras y juveniles en cada cayo, para caracterizar la población y su éxito reproductivo (González et al., 2013).
Análisis de los datos. Se comparó la abundancia relativa de los lagartos (excepto C. nubila) de seis cayos para los tres muestreos. Se comprobaron primeramente la normalidad y homogeneidad de varianza mediante las pruebas de Kolmogorov Smirnov y Levene, respectivamente. Al no cumplirse las asunciones se realizó un ANOVA no paramétrico (Kruskal-Wallis) para la comparación entre los muestreos realizados (p ≤ 0.05) y a posteriori, una prueba de comparaciones múltiples de Dunn. Se determinó la similitud de la composición de especies entre los cayos mediante el índice de Jaccard. El procesamiento de los datos se realizó en los programas PAST versión 2.14 (Hammer et al., 2001) y R 3.4.0.
RESULTADOS
En los ocho cayos muestreados se han encontrado 11 especies de reptiles terrestres, pertenecientes a siete familias del orden Squamata, con tres subespecies endémicas del archipiélago de los Jardines de la Reina. Las familias mejor representadas son Dactyloidae y Leiocephalidae con tres y dos especies respectivamente (Tabla I).
Tabla I. Especies de reptiles terrestres en ocho cayos del archipiélago de los Jardines de la Reina, Cuba (Reptilia: Squamata)

*= subespecies endémicas. A = Anclitas; C = Caballones; CACH = Cachiboca; CAG = Caguamas; G = Grande; PG = Piedra Grande; CE = Cabeza del Este; CAS = Casimba.
El índice de Jaccard (Fig. 3) mostró que los cayos Cabeza del Este y Casimba ubicados en los extremos este y oeste respectivamente poseen 100 % de similitud entre ellos, pero se diferencian marcadamente del resto de los cayos. También poseen altos valores de similitud los cayos Cachiboca y Piedra Grande, situados en la porción centro-este (80 %) y los cayos Grande, Caballones y Anclitas de la zona centro-oeste (75 %). El cayo que posee menor índice de similitud con respecto al resto de los cayos es Caguamas, con valores por debajo del 40 %.
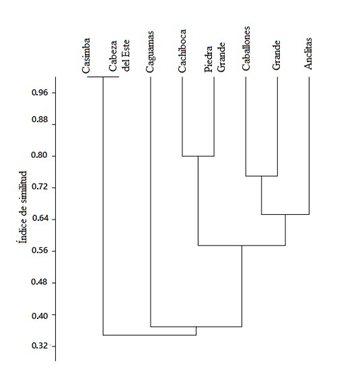
Figura 3. Índice de similitud de Jaccard para comparar la composición de reptiles en ocho cayos del archipiélago de los Jardines de la Reina, Cuba.
En los conteos realizados aplicando transectos en banda, solo se detectaron especies lagartos diurnos. Al comparar su abundancia relativa, se obtuvo que las especies dominantes difieren entre cayos. En el caso de Anclitas la más abundante fue L. carinatus cayensis (9.54 ± 5.12 ind/800 m2); en Piedra Grande, L. cubensis paraphrus (5.35 ± 2.51 ind/800 m2); en Cachiboca, P. auberi galbiceps (2.09 ± 2.40 ind/800 m2); en Caballones, A. sagrei (4.44 ± 2.95 ind/800 m2) y en los cayos Caguamas y Grande, C. nubila nubila (4.08 ± 3.06 ind/800 m2 y 2.78 ± 3.45 ind/800 m2, respectivamente) aunque en este último también fueron muy abundantes P. auberi galbiceps (2.63 ± 2.37 ind/800 m2) y A. sagrei (2.10 ± 2.07 ind/800 m2).
Al analizar las variaciones en la abundancia relativa entre los tres muestreos realizados, solo se encontraron diferencias significativas en Anclitas para L. carinatus cayensis y L. cubensis paraphrus y en Caguamas y Caballones para P. auberi galbiceps (Tabla II). La prueba a posteriori mostró que la abundancia relativa de L. cubensis paraphrus en Anclitas fue significativamente mayor en abril de 2018 con respecto a noviembre de 2017. En los casos de L. carinatus cayensis en Anclitas y P. auberi galbiceps en los cayos Caballones y Caguamas, se presentó la mayor abundancia en noviembre de 2017 (Tabla II).
Tabla II. Comparación de la abundancia relativa de cinco especies de lagartos en seis cayos del archipiélago de los Jardines de la Reina

Prueba de Kruskal-Wallis donde N: tamaño de la muestra, H: estadístico de la prueba, p probabilidad. En negritas se señalan valores de significación p ≤ 0.05.
Abundancia y proporción de hembras y juveniles de Cyclura nubila. Al comparar, por etapas y cayos se observaron tendencias diferentes en la abundancia relativa de C. nubila nubila. Los cayos Grande, Piedra Grande y Cachiboca mostraron mayor abundancia en septiembre y Anclitas en abril. En Caguamas fue mayor en el mes de noviembre de 2017 (Fig. 2).

Figura 4. Abundancia de Cylcura nubila nubila en individuos/ha, en seis cayos de Jardines de la Reina, Cuba en los meses de noviembre de 2017 y abril y septiembre de 2018.
La proporción de hembras fue superior al 50% en la mayoría de los cayos durante los muestreos realizados. En el 2018 se obtuvieron los mayores valores en abril para los cayos Anclitas, Caguamas, Grande y Piedra Grande, con una disminución en septiembre para los tres últimos. Caballones y Cachiboca presentaron la mayor proporción de hembras en noviembre de 2017. Con relación a la proporción de juveniles se observa un aumento en septiembre de 2018. Los valores en noviembre de 2017 fueron bajos en todos los cayos con respecto a septiembre de 2018, excepto en Caballones y Cachiboca (Tabla III).
Tabla III. Proporción de hembras y juveniles del total de individuos de la población de Cyclura nubila en seis cayos del archipiélago de los Jardines de la Reina

Muestreo en noviembre de 2017, abril y septiembre de 2018
DISCUSIÓN
Las especies de reptiles encontradas han sido previamente reportadas en el archipiélago por Estrada (2012) y Rodríguez-Schettino et al. (2013), con excepción de Chilabothrus angulifer encontrada en los cayos Grande y Caballones (Marichal, 2016b). Se encontraron nuevos reportes dentro del archipiélago; en cayo Anclitas se incorpora Anolis angusticeps, en Cayo Caballones Cubophis cantherigerus y en Piedra Grande L. cubensis paraphrus no reportados previamente para estos cayos.
En los cayos estudiados el ensamble de reptiles se caracteriza por especies diurnas y heliófilas, que en su mayoría utilizan los estratos bajos de la vegetación y el suelo, donde se establece la mayor parte de las interacciones. Cabeza del Este y Casimba poseen los mayores valores de similitud porque solo presentaron dos especies (Anolis sagrei y Cyclura n. nubila) de amplia distribución en archipiélago. En el resto de los cayos, el índice de similitud refleja la cercanía espacial y evolución geológica de los cayos. Los cayos Caballones y Cayo Grande se encuentran al oeste del archipiélago separados por el estero Las Auras. Están relacionados también los cayos situados en la porción centro-este, Piedra Grande y Cachiboca, que presentan afloramientos rocosos. El cayo con menor índice de similitud con respecto al resto de los cayos, es Caguamas espacialmente distante (hacia el este). El surgimiento de los cayos del Laberinto de las Doce Leguas ha estado relacionado a un crecimiento paulatino en la dirección Este-Oeste durante el Holoceno, apoyado en la forma de barras alargadas en esa dirección (Zúñiga, 2000). Los cayos del extremo oeste son menos desarrollados geológicamente, la vegetación está constituida generalmente por manglares, mientras que, los del este presentan afloramientos rocosos de altura considerable, con camellones de tormenta y formaciones vegetales mejor establecidas (González-de Zayas et al., 2006). Estos cayos están separados por canales intermareales como el canal de Caballones que separa los cayos Caballones y Anclitas, canal de Boca Piedra que separa Anclitas de los cayos de Piedra, y estos a su vez están separados de Cachiboca por el canal del mismo nombre. El surgimiento de los cayos y el desarrollo de formaciones vegetales pudieran explicar las similitudes entre las comunidades de reptiles. La presencia de canales de ancho considerable, como la pasa Caballones (3 km), pueden constituir una barrera para la dispersión de las especies dentro del archipiélago.
La abundancia relativa mostró que existen especies dominantes diferentes en cada cayo, posiblemente asociada a las características de sustrato y estructura del Matorral Xeromorfo Costero. En todos los cayos donde se encontraron L. carnatus cayensis y L. cubensis paraphrus en el mismo sitio de muestreo se observó una zonación en su distribución. Al parecer estas especies evitan las interacciones competitivas mediante la segregación espacial del hábitat que permite la coexistencia en los cayos donde ambas están presentes. L. carinatus cayensis se encontró asociada principalmente a la franja de vegetación más cercana a la costa, donde la radiación solar es elevada. L. cubensis paraphrus se encontró hacia el interior del cayo donde hay mayor cobertura de vegetación. La segregación trófica, temporal, espacial y climática reduce la competencia y por lo tanto permiten la coexistencia de varias especies (Pianka, 1973). En Anclitas la abundancia significativamente mayor de L. cubensis paraphrus en abril de 2018 con respecto a noviembre de 2017 puede deberse a un aumento en la detectabilidad de los individuos debido a los despliegues territoriales, el cortejo y la cópula propios del pico reproductivo. Martínez-Reyes (1994) encontraron que la subespecie L. cubensis cubensis manifiesta aumentos de la actividad reproductiva en los meses de abril y julio.
En el caso de L. carinatus cayensis en Anclitas y P. auberi en Caballones y Caguamas los resultados fueron contrarios a lo esperado y se manifestó también en otras especies abundantes, aunque no de forma significativa. Este aumento de la abundancia relativa en el archipiélago Jardines de la Reina en noviembre, probablemente esté asociado a las condiciones abióticas que caracterizaron el clima de 2017, con abundantes precipitaciones y altas temperaturas, especialmente debido al paso del huracán Irma (categoría 5) en septiembre de 2017. La temperatura, el fotoperiodo y las precipitaciones son factores que se han planteado pueden ser importantes en la reproducción estacional de los reptiles (Brown y Shine, 2006).
Abundancia y proporción de hembras y juveniles de Cyclura nubila. C. nubila nubila, es una subespecie endémica y considerada según González et al. (2012) como vulnerable debido al decline de sus poblaciones por la pérdida de hábitats y la caza indiscriminada. Estos autores estiman que encuentra distribuida actualmente con relativa abundancia, sólo en ciertos lugares de las costas y en los cayos que rodean la isla de Cuba. En el archipiélago de los Jardines de la Reina tiene una amplia distribución y en cayo Caguamas muestra la mayor abundancia relativa. En el resto de los cayos la abundancia se mantiene por debajo de 10 individuos/ha. Las poblaciones de C. nubila nubila en los Jardines de la Reina son consideradas de baja abundancia relativa (por debajo de 20 individuos/ha) y alta variabilidad (40 %) entre meses y años (González et al., 2014), esto último se manifiesta al analizar la abundancia relativa en diferentes etapas del año. Estos autores resaltan el caso de Cayo Caguamas como el de mayores valores, comportamiento que puede estar dado por la mayor área y heterogeneidad de hábitats (formaciones vegetales y sustratos) con relación al resto de los cayos. Presenta, además, una Estación Biológica de la Empresa Nacional para la Protección de la Flora y la Fauna (ENPFF), donde numerosos individuos de la especie se agregan en busca de agua y restos de comida. El suministro de comida puede alterar el comportamiento y la fisiología de esta especie (Knapp et al., 2013).
La mayor proporción de hembras en abril de 2018 en los cayos Anclitas, Caguamas, Grande y Piedra Grande puede estar asociada al cortejo y la cópula que comienzan en este período. Durante esta etapa los machos dominantes defienden su territorio y retienen a varias hembras dentro de su rango de hábitat (González-Rossell, 2018). La probablididad de detectar hembras es mayor en etapa pre y reproductiva porque estas permanencen cuidando los nidos (Christian, 1986). Además, los machos de baja categoría pasan mayor tiempo en la periferia entre territorios, mientras que aquellos sin catergoría social se mueven a lo largo de los territorios y exhiben conductas subordinadas (Alberts et al., 2002). En septiembre disminuyen estos valores debido al comienzo de la etapa post- reproductiva, periodo en el que eclosionan los huevos.
En los cayos Caballones y Cachiboca la proporción de hembras fue mayor en noviembre de 2017 debido a que en los otros dos muestreos aumentó la cantidad de individuos adultos a los que no fue posible determinar el sexo. La proporción de sexos puede variar de un año a otro y entre épocas (González et al., 2014) de ahí que existan variaciones en los valores de los años 2017 y 2018.
Con relación a la proporción de juveniles se observa un aumento en el mes de septiembre de 2018 en el que algunos individuos fueron observados alimetándose de inflorescencias de Coccothrinax litoralis (León). En la etapa post- reproductiva se suman a los no adultos de años anteriores, los juveniles nacidos en el periodo reproductivo del propio año. Los valores en noviembre de 2017 fueron bajos en todos los cayos debido posiblemente a la baja disponibilidad de recursos y disminución de la tasa de supervivencia de la especie asociado a las condiciones climáticas del año. La variabilidad en la abundancia de la especie, sexo y juveniles entre etapas confirma que la especie es estratega K con alta supervivencia de adultos por año, maduración sexual tardía y baja fecundidad, y cuidado parental del nido (Clobert et al., 1998; Pianka, 1970).
En el archipiélago de los Jardines de la Reina las comunidades de reptiles presentan baja diversidad y alto endemismo, lo cual pudiera estar asociado al aislamiento ecológico y geográfico al que están sometidas; características que según Clark y Dingwall (1985) resaltan la importancia de los sistemas insulares como áreas protegidas. Gran parte del archipiélago de los Jardines de la Reina fue declarado Parque Nacional en el 2010 por el Comité Ejecutivo del Consejo de Ministros de Cuba, lo que ha permitido la conservación de sus valores naturales.
CONCLUSIONES
Las especies encontradas han sido previamente reportadas para el archipiélago, aunque se incluyen nuevos reportes en los cayos Anclitas, Caballones y Piedra Grande, reflejo del insuficiente muestreo previo del área. La similitud entre grupos de cayos en cuanto a composición de reptiles refleja la cercanía espacial y surgimiento de los cayos en el archipiélago. Las especies que mostraron una amplia distribución fueron P. auberi galbiceps, A. sagrei y C. nubila nubila, aunque las especies dominantes difieren entre cayos y existen variaciones estacionales en la abundancia relativa de todas las especies. Cayo Caguamas presentó mayor abundancia de C. nubila nubila debido a la mayor extensión del matorral xeromorfo costero con relación a otros cayos. La proporción de hembras de esta especie reflejó el carácter poligino y la proporción de juveniles aumenta al final de la etapa reproductiva, aunque las condiciones climáticas adversas del 2017 pueden haber disminuido la tasa de supervivencia de juveniles de ese año. La presencia de subespecies endémicas de lagartos en el archipiélago confirma la relevancia del área protegida para Cuba.
AGRADECIMIENTOS
Esta investigación fue posible gracias al apoyo logístico de Sucursal Marlin Jardines de la Reina, Sweet SPA SA., Avalon y Oceans for Youth Foundation. A Victor Manuel Portales Dima que participó en la recolección de los datos.
REFERENCIAS
Alberts, C. A., Lemm, J. M., Perry, A. M., Morici, L. A., & Phillips, J. A. (2002). Temporary alteration of local social structure in a threatened population of Cuban iguanas (Cyclura nubila). Behavioral Ecology and Sociobiology, (51), 324–335.
Arias, A. (2009). Ecología de las comunidades de lagartos de cayo Santa María, Villa Clara, Santa Clara [Tesis de doctorado, Universidad de Alicante]. https://dialnet.unirioja.es/ servlet/tesis?codigo=130078.
Brown, G. P., & Shine, R. (2006). Why do most tropical animals reproduce seasonally? Testing hypotheses on an Australian snake. Ecology, 87(1), 133–143.
Christian, K. (1986). Aspects of the life history of Cuban iguanas on Isla Magueyes, Puerto Rico. Caribbean Journal of Science, 22(3–4), 159–164.
Clark, M. R., & Dingwall, P. R. (1985). Conservation of islands in the Southern Ocean: a review of the protected areas of Insulantarctica. World Conservation Union, ISBN: 2-88032-503- X. (188 pp.). https://portals.iucn.org/library/node/5921
Clobert, J., Garland, T. Jr., & Barbault, R. (1998). The evolution of demographic tactics in lizards: a test of some hypotheses concerning life history evolution. Journal of Evolutionary Biology, (11), 329–364.
Estrada, A. R. (2012). The Cuban Archipelago. En R. Powell, & W. H. Henderson (Eds.), Island list of West Indian amphibian and reptiles. The Bulletin of the Florida Museum of Natural History, 51(2): 113–125.
González, A., Berovides, V., Alonso, M., & Cobián, D. (2012). Cyclura nubila nubila. En H, González, L. Rodríguez, A. Rodríguez, C. A. Mancina e I. Ramos (Eds.), Libro Rojo de los Vertebrados de Cuba. Editorial Academia.
González, A., Berovides, V., Alonso, M., & López, M. (2013). Protocolo para el monitoreo de Cyclura nubila nubila. Aplicación de un enfoque regional al manejo de las áreas marino- costeras protegidas en la región archipiélagos del Sur de Cuba. Proyecto GEF-PNUD, La Habana.
González, A., Berovides, V., Cobián, D., Linares, J., Espinosa, L., Milián, J., Abad, G., Alonso, M., López, M., Alonso, Y., Corona, J. M., & Palacio, E. (2014). Resultados del Programa de monitoreo de la iguana (Cyclura nubila nubila). En A. Hernández, (Comp), Estado actual de la biodiversidad marino costera, en la región de los archipiélagos del sur de Cuba (pp.142–157). Resultados de la implementación del Sistema de Monitoreo de la Biodiversidad, Centro Nacional de Áreas Protegidas: Impresos Dominicanos s. r. l. http://repositorio.geotech.cu/jspui/handle/1234/161
González-de Zayas, R., Zúñiga-Ríos, A., Camejo-Cardoso, O., Batista-Tamayo, L. M., & Cárdenas-Murillo, R. (2006). Atributos físicos del ecosistema Jardines de la Reina. En Ecosistemas costeros: biodiversidad y gestión de recursos naturales. Compilación por el XV Aniversario del Centro de Investigaciones de Ecosistemas Costeros. Editorial CUJAE (296–351).
González-Rossell, A. (2018). Ecología y conservación de la iguana (Cyclura nubila nubila) en Cuba [Tesis de doctorado. Universidad de Alicante]. https://rua.ua.es/dspace/ bitstream/10045/81607/1/ tesis_amnerys_gonzalez_rosell.pdf
Hammer, O., Harper, D. A. T., & Ryan, P. D. (2001). PAST: Paleontological statistics software package for education and data analysis. Palaeontología Electrónica, 4(1), 9.
Knapp, C. R, Hines, K. N., Zachariah, T. T., Perez-Heydrich, C., Iverson, J. B., Buckner, S. D., Halach, S. C. Lattin, C. R., & Romero, L. M. (2013). Physiological effects of tourism and associated food provisioning in an endangered iguana. Conservation Physiology, (1), 1–13. https://doi.org/10.1093/conphys/cot032
Marichal, E. (2016a). El majá de Santa María, Chilabothrus angulifer (Squamata: Boidae), en el Archipiélago Jardines de la Reina: nuevo registro de distribución. Poeyana, (503), 64–65.
Marichal, E. (2016b). Dieta de Cyclura nubila nubila Gray, 1831 (Squamata: Iguanidae) en dos cayos del Archipiélago de los Jardines de la Reina, Cuba. Acta Zoológica Mexicana (ns), 32(1), 195–198.
Marichal, E., & López, D. (2012). Reptiles terrestres de los cayos de la región-central del golfo de Ana María, Cuba. Revista de Investigaciones Marinas, 32(2), 74–77.
Martínez, E., (2020). Vegetación y flora asociada de los principales cayos del archipiélago de los Jardines de la Reina, Cuba. Revista del Jardín Botánico Nacional, Universidad de la Habana, (41), 175–188.
Martínez- Reyes, M. (1994). Aspectos reproductivos de Leiocephalus cubensis cubensis (Iguania: Tropiduridae) en una localidad de Ciudad de La Habana, Cuba. Ciencias Biológicas, (27), 83–89.
Parada, A., Cardoso, P., Aguilar, A., Arias, A., & Bello, O. (2007). Expedición terrestre a la porción Centro-Oriental del archipiélago de Jardines de la Reina, Cuba. Informe correspondiente al Monitoreo del Parque Nacional Jardines de la Reina (1–24).
Pianka, E. R. (1970). On r- and K-selection. American Naturalist, (100), 592–597.
Pianka, E. R. (1973). The structure of lizard communities. Annual Review of Ecology and Systematics, 4(1), 53–74.
Rocha, C. F. D., Dutra, G. F., Vrcibradic, D., & Menezes, V. A. (2002). The terrestrial reptile fauna of the Abrolhos Archipelago: species list and ecological aspects. Brazilian Journal of Biology, 62(2), 285–291.
Rodríguez, L., & Rivalta, V. (2003). Lista de especies. En L. Rodríguez, L. (Ed). Anfibios y reptiles de Cuba. Vaasa: UPC Print (pp.162–165). http://repositorio.geotech.cu/jspui/ bitstream/1234/1428/1/Anfibios%20y%20reptiles%20de%20Cuba%20%28extracto%29.pdf
Rodríguez-Schettino, L. Mancina, C. A., & Rivalta, V. (2013). Reptiles of Cuba: checklist and geographic distributions. Smithsonian Herpetological Information Service, (144), 1–96.
Schwartz, A., & Henderson, R. W. (1991). Amphibians and reptiles of the West Indies: Descriptions, distributions, and natural history, (720 pp). University of Florida Press.
Torres, J., Rodríguez-Cabrera, T. M., & Marrero, R. (2017). Reptiles. En C. A. Mancina y D. D. Cruz (Eds), Diversidad biológica en Cuba: métodos de inventario, monitoreo y colecciones biológicas. Editorial AMA.
Vitousek, P., Loope, L. L., & Adsersen, H. 1995. Islands: biological diversity and ecosystem function, (238 pp.). Springer-Verlag, XVII.
Zúñiga, A. (2000). Caracterización básica de la geología de los cayos de la porción centro occidental del sub-archipiélago Jardines de la Reina. Cayos Algodón Grande, Anclitas y Caballones. Revista Enlace, 6(33), 1–5.
