INTRODUCCIÓN
Entre los animales hermafroditas simultáneos se encuentran los gastrópodos panpulmonados (Bouchet et al., 2017; Schärer y Ramm, 2016). Entre estos gastrópodos, en la superfamilia Helicoidea la mayoría de las especies posee un aparato del dardo como órgano copulatorio auxiliar (Davison y Mordan, 2007; Koene y Schulenburg, 2005). Este órgano se conforma por una glándula cuya posición y morfología es variable (Nordsieck, 1987; Schileyko, 1991). Como parte del órgano copulatorio auxiliar, varias especies de caracoles helicoideos poseen en el interior del saco del dardo una estructura calcárea o quitinosa, llamada dardo del amor (Lodi y Koene, 2016).
Durante el apareamiento, los caracoles con aparato del dardo presionan el tegumento de sus parejas con un dardo cubierto de mucus (Davison et al., 2005; Lodi et al., 2017). Esta conducta, conocida como “disparo del dardo”, es la más estudiada de las moduladas por la selección sexual en los caracoles pulmonados (Baur, 2010; Baur y Baur, 2017). Además, las pautas de uso del aparato del dardo son diferentes entre las especies de Helicidae (Chase, 2007), Bradybaenidae (Kimura y Chiba, 2013; Koene y Chiba, 2006) y Cepolidae (Reyes-Tur et al., 2015, 2020).
En general, la función del dardo es la transferencia a la pareja respectiva de secreciones producidas en las glándulas accesorias. Estas secreciones aumentan el éxito de la fertilización del esperma transferido después del pinchazo del dardo (Kimura et al., 2014; Lodi y Koene, 2016). Para Cornu aspersum (Müller, 1774), Stewart et al. (2016) identificaron una alohormona cuya transferencia, a través del dardo, provoca el acortamiento del órgano receptor de espermatóforos y el cambio de configuración del canal copulatorio.
En los caracoles con aparato del dardo los espermatozoides son transferidos por el espermatóforo (Baur y Baur, 2017). Aunque la mayoría de los espermatozoides se degradan en la bolsa copulatriz, una parte llega hasta los túbulos espermáticos del saco espermático donde se almacenan hasta que ocurre la fertilización (Garefalaki et al., 2017). El espermatóforo reduce el riesgo de degradación de los espermatozoides en la bolsa y facilita su transferencia exitosa al saco espermático (Tompa, 1984).
Los caracoles cubanos con aparato del dardo pertenecen a Cepolidae (Bouchet et al., 2017), aunque la familia está distribuida en las Antillas Mayores y Menores, las Islas Caimán, la Florida y sus cayos (Miller y Naranjo-García, 1991). Según los árboles filogenéticos de la superfamilia Helicoidea, obtenidos a partir de análisis de marcadores moleculares (Calcutt et al., 2020; Koene y Schulenburg, 2005; Razkin et al., 2015; Sei et al., 2017), Cepolidae constituye una familia basal y probablemente primitiva entre los caracoles con aparato del dardo.
Pese a las actualizaciones sobre la filogenia molecular de Helicoidea, su taxonomía supraespecífica tiene como base fundamental las estructuras reproductivas accesorias, incluido el aparato del dardo (Nordsieck, 2013). Según Nordsieck (2017), la familia Cepolidae se caracteriza por la ausencia de divertículo en el órgano receptor de espermatóforos y la presencia de un aparato del dardo simple, conformado por un saco del dardo con una glándula pedunculada apical. Conjuntamente, posee un saco atrial, con una o dos glándulas mucosas en la base. Sin embargo, para Guladentia Clench y Aguayo, 1951 y Jeanneretia Pfeiffer, 1877 se ha señalado ausencia de saco del dardo y presencia de una estructura similar al dardo, pero de consistencia más blanda que se encuentra unida a la papila muscular (Hernández et al., 2021, 2022). Actualmente, para Cuba, la familia Cepolidae está representada por diez géneros, entre ellos Setipellis Pilsbry, 1926 (Hernández et al., 2020).
El género Setipellis es endémico de Cuba y hasta el momento está comprendido por una especie, Setipellis stigmatica (L. Pfeiffer, 1841), registrada fundamentalmente sobre suelo cársico, en los bosques de la mitad occidental del archipiélago cubano (Espinosa y Ortea, 1999). Baker (1943) fue el primero en analizar y describir los órganos genitales de Setipellis a través de dos individuos procedentes de Puertas de Ancón, Viñales, Pinar del Río. Posteriormente, Schileyko (2004) redescribió estas estructuras a partir del trabajo de Baker (1943). Además, se ha detectado variación interpoblacional del sistema reproductor (Bosch-Diaz, 2021; MéndezHernández, 2011).
En un apreciable número de especies animales la anatomía de los órganos reproductivos muestra evidencias de modificación como consecuencia de la selección sexual (Eberhard, 2015; Lodi y Koene, 2016). En caracoles terrestres con aparato del dardo tiene lugar una coevolución morfológica entre el diseño de los dardos y el sistema reproductivo, tal como ha sido revelado por el análisis comparativo de Koene y Schulenburg (2005). No obstante, existe escasez y dispersión de la información referente a las observaciones de los órganos genitales durante el apareamiento. Este tipo de información es útil para determinar cómo se utilizan los órganos sexuales, comprender sus funciones y ampliar el ámbito de la generalización de las pautas conductuales (Koene y Chiba, 2006). Asimismo, la inclusión de las pautas de la conducta de apareamiento en el análisis filogenético pudiera ser un objetivo atractivo para el futuro (Eberhard, 2011). Pese a su posición basal y primitiva entre los helicoideos, sobre Cepolidae se han publicado datos del apareamiento únicamente para especies de Polymita Beck 1837 (Reyes-Tur et al., 2015; Reyes-Tur et al., 2000; Reyes-Tur et al., 2020; Reyes-Tur y Koene, 2007) y Jeanneretia (Hernández, 2015). En el presente trabajo se estudia la conducta de apareamiento de S. stigmatica con la finalidad de comprender si sus pautas se corresponden con lo conocido sobre la evolución del aparato de dardo.
OBJETIVOS
-Caracterizar la conducta de apareamiento de Setipellis stigmatica en cautiverio, incluido el uso del dardo.
-Describir la morfología del dardo y el espermatóforo de Setipellis stigmatica.
MATERIALES Y MÉTODOS
Recolección de ejemplares. Para la caracterización del apareamiento de S. stigmatica se recolectaron 13 individuos adultos (i.e.: con labio reflejado) procedentes de Escaleras de Jaruco, provincia Mayabeque, en las Región Occidental de Cuba.
Mantenimiento de caracoles en cautiverio. La conducta de apareamiento fue estudiada en cautiverio. Para disminuir el efecto de probables apareamientos anteriores, los individuos recolectados se aislaron entre siete y 14 días en recipientes plásticos de 1 500 mL. La alimentación y las condiciones de la colonia en cautiverio (i.e.: temperatura, humedad relativa y fotoperíodo) se mantuvieron según Rodríguez-Potrony et al. (2020).
Conducta de apareamiento en cautiverio. En cada jornada de observación, se colocaron de cuatro a nueve individuos, previamente marcados con tinta indeleble, en un recipiente de 30 X 20 X 17 cm con el fondo y las paredes humedecidas para facilitar las cópulas. Las observaciones se iniciaron entre las 08:00 h y 19:00 h; en el horario nocturno se utilizó iluminación fluorescente en el laboratorio. Las parejas detectadas en cortejo se aislaron cuidadosamente a otro recipiente con similares características.
Para la descripción cualitativa y el análisis cuantitativo de los eventos conductuales se tomaron fotos y videos utilizando una cámara digital Nikon-Cool Pix s9600. Se determinó la duración en minutos (min) de cada etapa de la conducta de apareamiento: cortejo, cópula y post-cópula, según los criterios de Reyes-Tur et al. (2020). Se analizaron videos de siete apareamientos, en noviembre del 2013 (n = 2) y entre enero y febrero del 2016 (n = 5). En uno de los apareamientos se grabó exclusivamente el cortejo, y en seis las tres etapas. Para cada toma de video, se cuantificó el número de contactos del aparato del dardo, parcial o completamente evertido, contra el cuerpo del otro individuo (i.e.: uso del aparato del dardo), su frecuencia (segundos o minutos entre cada contacto), los sitios o regiones de contacto y la duración (en min).
Para cuantificar los sitios de contacto, se diferenciaron tres regiones: cefálica, pedal medio y pedal posterior. La cefálica incluyó desde el pliegue de la cavidad del manto, seguida por la cabeza con ambos pares de tentáculos, el atrio parcialmente evertido y la región cefálica ventral. Después del apareamiento cada miembro de la pareja fue aislado en su recipiente original.
Disección y microscopía. Los individuos sacrificados para el análisis anatómico se anestesiaron previamente con una inyección de 0.5 mL de MgC126H2O (50 mM). Posteriormente, se realizó la disección para aislar el sistema reproductor bajo un estereomicroscopio Novel NSZ–808 y el material de disección adecuado. Los dardos y espermatóforos fueron fotografiados bajo el estereomicroscopio con cámara digital acoplada, Canon 500D. A partir de las imágenes tomadas, se realizaron las mediciones mediante el programa ImageTool 3.0 (Wilcox et al., 2002), sobre la base de una escala previamente calculada con auxilio de un micrómetro ocular, según los criterios de Reyes-Tur et al. (2020).
Procesamiento de dardos y espermatóforos. Después del apareamiento, en tres parejas se examinó la presencia o ausencia del dardo y su estado (i.e.: roto o intacto), así como la transferencia de espermatóforo. Para examinar la presencia o ausencia del dardo y su estado se introdujo el aparato del dardo en una solución de NaOH (2 N) durante 5 horas para eliminar tejidos y mucus adyacentes al dardo. Para verificar la transferencia de espermatóforos, se realizó la disección de la bolsa copulatriz y su conducto, en los ejemplares utilizados para estudiar el dardo.
Se midió el largo máximo de cuatro dardos, así como el largo total de un espermatóforo y de sus partes: cuello, cuerpo y cola (todo expresado en mm).
Tanto para la conducta de apareamiento como la morfometría se caracterizó cada variable mediante el cálculo de la media y el error estándar.
RESULTADOS
Conducta de apareamiento en cautiverio. El apareamiento se dividió en tres etapas: cortejo, cópula y post-cópula. Su duración total fluctuó entre 93 y 279 min para una media ± error estándar de 164 ± 27 min (n = 6). En todos los apareamientos existieron eventos repetitivos como el contacto táctil entre los individuos en posición frente a frente, las reiteradas eversiones y retracciones de los atrios genitales durante el cortejo, los intentos de acoplamiento, el uso del aparato del dardo y la ingestión de secreciones mucosas producidas en los órganos genitales parcialmente evertidos (Fig. 1).
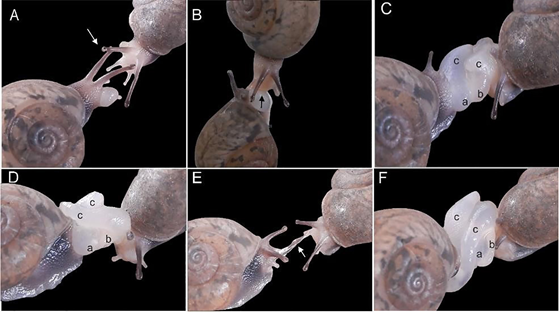
Figura 1. Etapas del cortejo y la cópula en cautiverio de Setipellis stigmatica. A) Contacto de los tentáculos oculares (flecha blanca) entre individuos proclives al cortejo, en estado inicial de eversión de sus órganos genitales; B) pareja durante el cortejo, el individuo que está en la parte superior presiona su rádula sobre el atrio parcialmente evertido de su pareja (flecha negra); C y D) parejas durante el cortejo con diferentes niveles de eversión del aparato del dardo; E) pareja en cortejo donde el individuo de la izquierda ingiere secreciones mucosas de los órganos genitales de su pareja; F) pareja en cópula con máximo nivel de eversión de los órganos genitales. Durante el apareamiento se observan: poro vaginal (a), lóbulo peneal (b) y aparato del dardo en contacto con diferentes regiones del cuerpo (c).
El cortejo fluctuó entre 49 y 227 min, su promedio de 107 ± 22 min (n = 7) representó el 67 % de la duración del apareamiento. Esta etapa comenzó cuando un par de individuos proclives a iniciar el cortejo, con diferentes grados de eversión parcial de sus atrios genitales, tuvieron contacto táctil con cualquier parte del cuerpo, fundamentalmente la región cefálica (Fig. 1A, B). La eversión parcial de los órganos genitales implicó la salida al exterior del lóbulo peneal y el poro vaginal, a ambos lados del aparato del dardo que ocupó una posición central (Fig. 1C, D). Cuando ocurrió la eversión máxima del aparato del dardo, se observó en el interior del saco atrial, el saco del dardo y la glándula pedunculada. Durante el cortejo se realizaron eversiones y retracciones de los órganos genitales. Los periodos en que se mantuvieron retraídos los órganos genitales se consideraron como pausas, cuya duración se extendió entre uno y 12 min.
Cuando los órganos genitales estaban parcialmente evertidos, sin contacto entre ellos, hubo contacto entre los tentáculos oculares y se registraron movimientos laterales de la región cefálica (Fig. 1A). Además, uno o ambos individuos rasparon con su rádula la región bucal y los órganos genitales parcialmente evertidos de su pareja (Fig. 1B), la cual se retrajo como respuesta a la acción traumática. El contacto de los órganos genitales parcialmente evertidos facilitó el acomodo de los poros vaginales y lóbulos peneales (Fig. 1C, D), después de intentar el acoplamiento entre cuatro y 14 veces (8 ± 1, n = 7). Al mismo tiempo, el aparato del dardo frotó diferentes zonas del cuerpo de la pareja; en ambos miembros y el tentáculo cefálico derecho se retrajo completamente (Fig. 1C, D). Durante las pausas de eversión de los órganos genitales quedó colgado entre la pareja un cordón de mucus secretado por los genitales el cual generalmente fue ingerido por uno de los miembros de la pareja (Fig. 1E). Luego de los intentos de intromisión, el acoplamiento simultáneo marcó el final del cortejo y el inicio de la cópula.
La duración de la cópula fluctuó entre 33–57 min, su valor medio de 43 ± 4 min (n = 6) representó el 27 % de la duración del apareamiento y se inició con la intromisión simultánea de ambos penes. En esta etapa, los individuos se mantuvieron sin reptar, con los tentáculos retraídos parcial o completamente y el aparato del dardo contactó diferentes sitios del cuerpo de la pareja (Fig. 1F). La cópula culminó con el desacople simultáneo de ambos penes.
Como promedio, la post-cópula se extendió 9 ± 1 min (entre siete y 13 min, n = 6) y representó el 6 % de la duración del apareamiento. Después del desacople de ambos penes los órganos genitales comenzaron su retracción, mientras los tentáculos alcanzaron su eversión máxima. Luego de la separación de la pareja también ocurrió ingestión de los restos de secreciones mucosas sobre el sustrato de apareamiento y el cuerpo de cada animal. Esta etapa culminó con el cese del contacto táctil.
Usos del aparato del dardo. El 67 % (n = 284) de los usos del aparato del dardo ocurrieron de forma unilateral. El aparato del dardo es flexible, largo y fino cuando está completamente extendido (Fig. 1F). La mayoría de sus contactos estuvieron ubicados en la región cefálica (74 %), aunque no se registraron contactos entre aparatos del dardo. El resto de los contactos tuvieron lugar en la región media del pie (25 %) y la concha (1 %).
Fueron detectadas dos formas de uso del aparato del dardo, los frotes y los pinchazos (n = 284). De los dos, el frote resultó la forma más frecuente, como promedio un frote cada 4 ± 1 min (límites: uno entre 3–7 min, n = 243) y el pinchazo la más rara, uno cada 28 ± 4 min (entre 18–46 min, n = 41). La frecuencia de uso del aparato del dardo (i.e.: frotes y pinchazos) fue mayor durante la cópula, cada 2 ± 0.4 min (entre 1–4 min, n = 157); comparada con el cortejo, cada 10 ± 2 min (entre 4–18 min, n = 116). Sólo el 4 % de uso del aparato del dardo, se detectó durante la post-cópula.
El tipo de uso del aparato del dardo de mayor duración promedio fue el frote (2 ± 0.1 min, n = 246). Durante el frote el aparato del dardo rozó, con el saco atrial evertido, diferentes regiones del cuerpo de la pareja, fundamentalmente alrededor del poro vaginal. Estos no provocaron retracción visible de la zona frotada.
Durante el frote se dispersó, sobre las regiones de contacto, el mucus secretado por el orificio del aparato del dardo y la superficie del saco atrial evertido. La superficie de este saco evertido es mayormente rugosa, aunque lisa en su extremo.
Los pinchazos siempre ocurrieron unilateralmente, con duración de 1 segundo y mayor frecuencia durante la cópula (61 %, n = 41). Este evento implicó que el aparato del dardo alcanzara su eversión máxima y se curvara (Fig. 1F). En estas condiciones el pinchazo tuvo lugar cuando su extremo contactó el cuerpo de su pareja y causó la retracción inmediata de la zona impactada, así como de la región cefálica.
Dardos y espermatóforos. Después de la cópula se registraron dardos en cinco de los individuos analizados (n = 6), en uno de ellos el dardo estaba roto. Los dardos tienen aspecto de estilete delgado y ligeramente curvado (Fig. 2), con largo máximo entre 1.63–2.21 mm (1.99 ± 0.13; n = 4).

Figura 2. Vista lateral de dardos de Setipellis stigmatica.
Para las tres parejas sacrificadas después del apareamiento se comprobó presencia del espermatóforo en la bolsa copulatriz de cinco individuos, en tres de ellos estaba parcialmente degradado y en otro muy fragmentado. Tampoco se encontró espermatóforo en el complejo peneal de la pareja del individuo que no lo recibió en su órgano receptor. Para el único espermatóforo íntegro, el largo resultó 5.36 mm y estuvo conformado por el cuello, el cuerpo y la cola (Fig. 3). El cuello es aguzado en su región anterior y presenta una serie de crestas que le confieren apariencia espiralada (largo: 1.91 mm; ancho máximo: 0.31 mm). A continuación, se encuentra el cuerpo (largo: 1.43 mm; ancho máximo: 0.5 mm) con una protuberancia cercana a su unión con el cuello. Además, en el cuerpo existen crestas laterales menos pronunciadas que en el cuello. La cola, tiene grosor uniforme y extremo distal romo (largo: 2.02 mm; ancho máximo:0.43 mm). No se detectaron espinas en ninguna región del espermatóforo (Fig. 3).
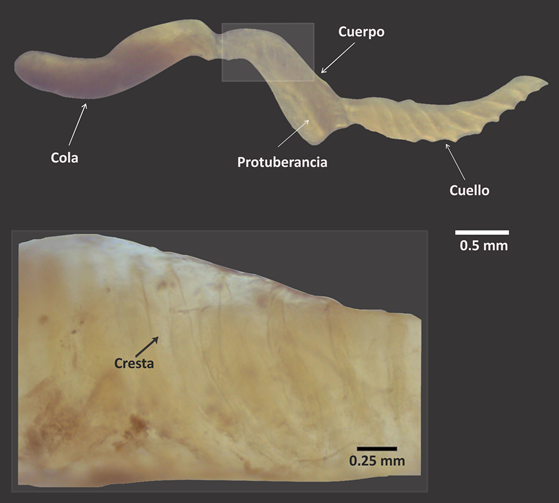
Figura 3. Morfología del espermatóforo de un ejemplar de Setipellis stigmatica. Se señala una de las crestas (flecha negra) en el cuerpo.
DISCUSIÓN
Conducta de apareamiento en cautiverio. El apareamiento de S. stigmatica posee tres etapas: cortejo, cópula y post-cópula, lo cual constituye un patrón similar a otras especies de Cepolidae (Reyes-Tur et al., 2020). Su duración media de 164 min fue cercana a la reportada para Polymita muscarum (Lea, 1834), (142 ± 29 min: Reyes-Tur y Koene, 2007). Sin embargo, la duración promedio del apareamiento de S. stigmatica fue menor que P. brocheri (Gutiérrez in Pfeiffer, 1864) (208 ± 23 min: Reyes-Tur et al., 2020) y P. picta (Born, 1780) (264 ± 12 min: Reyes-Tur et al., 2015). Además, a diferencia de estas últimas especies, para S. stigmatica en ningún caso se registró movimiento circular de algún miembro de la pareja.
En S. stigmatica, el cortejo representó el 67 % de la duración del apareamiento. Sin embargo, la cópula representó el 27 % de la duración del apareamiento; a diferencia de las especies cubanas con aparato del dardo estudiadas previamente, donde la cópula representó más del 50 % del apareamiento (Reyes-Tur et al., 2020). Lo anterior sugiere que en S. stigmatica el cortejo es una etapa con apreciable demanda energética, donde el contacto táctil, el uso del aparato del dardo, así como la secreción, la transferencia y la ingestión de secreciones mucosas producidas en los órganos genitales pueden considerarse signos de motivación sexual. Tal como se ha sugerido para otros caracoles terrestres (Baur, 2010; Baur y Baur, 2017).
Usos del aparato del dardo. Para los apareamientos de S. stigmatica, se registró frecuencia promedio de un frote cada 4 min (límites: entre 3 y 7 min) y un pinchazo cada 28 min (límites: entre 18 y 46 min). Estos valores indican menor frecuencia de uso del aparato del dardo que lo señalado para otros caracoles cubanos pertenecientes a Cepolidae, como P. muscarum, entre 30 s y 3 min (Reyes-Tur y Koene, 2007); P. picta, entre 1 y 7 min (Reyes-Tur et al., 2015) y P. brocheri, entre 30 s y 4 min (Reyes-Tur et al., 2020). Sin embargo, para las especies mencionadas, incluida S. stigmatica, la frecuencia de uso del aparato del dardo es menor que la informada para Euhadra subnimbosa (Kobelt, 1894), 151 pinchazos cada minuto (Koene y Chiba, 2006).
La posición central del aparato del dardo entre los órganos genitales parcialmente evertidos constituye una novedad de la morfología genital durante el apareamiento de los cepólidos. Además, entre los tipos de uso del aparato del dardo, para S. stigmatica, los frotes fueron los más frecuentes y los de mayor duración. Estos eventos son menos traumáticos y pudieran disminuir la intensidad del conflicto sexual pues no provocan trauma aparente a ningún miembro de la pareja (Reyes-Tur et al., 2015). La mayoría de los frotes estuvieron ubicados alrededor del poro vaginal, esto está probablemente relacionado con la transferencia de mucus producido por las glándulas accesorias y la estimulación de órganos femeninos internos relacionados con las zonas contactadas (Eberhard, 2015; Koene y Reyes-Tur, 2020). Cabe destacar, la ausencia de zona sensitiva, así como de frotes y pinchazos entre aparatos del dardo, los cuales se han registrado para otras especies cubanas con aparato del dardo (Reyes-Tur et al., 2020).
El evento más traumático, el pinchazo, resultó el menos frecuente y de menor duración. Los pinchazos sobre la región cefálica y los órganos genitales parcialmente evertidos son una vía para transferir el mucus secretado por las glándulas mucosas. Específicamente en C. aspersum, estas secreciones están compuestas por una alohormona que provoca el acortamiento del órgano receptor de espermatóforo y disminuye la resistencia femenina. Lo anterior incrementa la probabilidad de éxito del esperma transferido durante la fertilización (Lodi y Koene, 2016; Stewart et al., 2016). En general, los apareamientos traumáticos incrementan el éxito reproductivo mediante la superación de la resistencia femenina o la manipulación de los mecanismos postcopulatorios de selección de esperma (Lange et al., 2013).
Por otro lado, Koene et al. (2000) demostraron en C. aspersum, que la región anteromedial derecha del ganglio cerebral constituye una región evolutivamente conservada en el sistema nervioso de los gastrópodos. Esta región participa en el control de la conducta de apareamiento, a través de algunas neuronas específicamente sensitivas al estímulo táctil en la zona superior de los tentáculos cefálicos y alrededor del poro vaginal. Lo anterior coincide con las principales zonas de contacto del aparato del dardo detectadas para S. stigmatica.
Dardos y espermatóforos. El largo máximo de los dardos de S. stigmatica varió entre 1.63 y 2.21 mm, más corto a lo reportado para P. picta (entre 2.6 y 4.2 mm: Reyes-Tur et al., 2015) y P. brocheri (entre 2.1 y 2.6 mm: Reyes-Tur et al., 2020). No obstante, en relación con las dimensiones de la concha, el dardo de S. stigmatica posee una apreciable talla. Esto puede estar relacionado con la baja frecuencia de uso del aparato del dardo, puesto que los pinchazos de
S. stigmatica deben ser más profundos que en las especies mencionadas anteriormente. Además, Baminger y Haase (2000) plantearon que dardos más largos pueden trasferir productos de glándulas mucosas más largas, como es el caso de S. stigmatica.
De tres parejas sacrificadas después del apareamiento, solamente un individuo no presentó dardo en el saco. Lo cual indica que generalmente el dardo no se pierde durante el apareamiento, aunque también pueden existir individuos que lo pierdan o copulen sin dardos. Esto último ha sido confirmado para Bradybaena pellucida (Férussac, 1821), donde el dardo se forma sólo después del primer apareamiento (Kimura y Chiba, 2015).
En el presente trabajo se describió un espermatóforo de S. stigmatica de Escaleras de Jaruco. Este resultó más corto que en P. picta (Reyes-Tur et al., 2015) y P. brocheri (Reyes-Tur et al., 2020). Probablemente, se deba a que las dimensiones de las estructuras donde se forma el espermatóforo (i.e.: flagelo y epifalo de S. stigmatica) son menores que en Polymita.
El espermatóforo de S. stigmatica carece de espinas, a diferencia de P. picta (Reyes Tur et al., 2015) y P. brocheri (Reyes-Tur et al., 2020). Las espinas favorecen el retraso del movimiento del espermatóforo al interior del conducto de la bolsa copulatriz y facilitan que la cola se mantenga fuera del mencionado conducto (Garefalaki et al., 2017; Kimura y Chiba, 2013). Otra característica relevante del espermatóforo es la presencia de una protuberancia en la región anterior del cuerpo. Esta protuberancia en la zona de unión entre el cuerpo y el cuello, sugiere una función similar a las espinas registradas en los espermatóforos de Polymita (Reyes-Tur et al., 2020). Al retrasar el movimiento del espermatóforo hacia el conducto de la bolsa copulatriz debe incrementarse la probabilidad de desplazamiento de los espermatozoides desde la cola hasta la bolsa espermática.
La pauta regular del apareamiento de S. stigmatica respalda la idea de que en los caracoles de la familia Cepolidae el aparato del dardo es utilizado repetidamente durante todo el apareamiento a través de pinchazos y frotes, usualmente sin perder el dardo (Lodi y Koene, 2016). Estas características conductuales pudieran ser ancestrales en la evolución del aparato del dardo. Además, pese a que son necesarios más estudios para demostrar el efecto de la protuberancia del espermatóforo, el presente trabajo aporta evidencias de la relación potencial entre la morfología de los dardos, los espermatóforos y el sistema reproductor, especialmente el órgano receptor de espermatóforo.
CONCLUSIONES
En cautiverio, el apareamiento de S. stigmatica posee tres etapas: cortejo, cópula y post-cópula. El cortejo representó más de la mitad de su duración e incluyó contactos táctiles y orales, así como consumo de mucus secretado por los órganos genitales. Las parejas no mostraron movimientos circulares, pero utilizaron sus aparatos del dardo mediante frotes y pinchazos, dirigidos fundamentalmente a la región anterior del cuerpo de su pareja, usualmente sin pérdida del dardo.
Los dardos de S. stigmatica tienen aspecto de estilete delgado y ligeramente curvado. Por otro lado, su espermatóforo consta de tres regiones: cuello, cuerpo y cola; aunque sin espinas posee crestas transversales en el cuello y el cuerpo. Existe una protuberancia en el cuerpo justo en su unión con el cuello.
AGRADECIMIENTOS
Agradecemos a la Oficina de Regulación y Seguridad Ambiental por los permisos de acceso y recolecta, así como a Lixán Manzano y Lizandra Y. Cepero Benítez por apoyar en el mantenimiento de los caracoles. Los comentarios y sugerencias de Henry Rodríguez-Potrony, Mario J. Gordillo Pérez, Denis Dennis Ávila, Ana Sanz Ochotorena, Alejandro Fernández Velázquez, Carlos Suriel y los revisores anónimos permitieron corregir las primeras versiones del manuscrito. El proyecto VLIRUOS: Valorización de la biodiversidad de Cuba Oriental en condiciones de cambio climático, la agencia NABU y Tino Sauer apoyaron financieramente en el mejoramiento de las condiciones de cautiverio.
REFERENCIAS
Baker, H. K. (1943). Some Antillean helicids. The Nautilus, 56(3), 81–91.
Baminger, H., & Haase, M. (2000). Variation of distal genitalia in the simultaneously hermafroditic land snail Arianta arbustorum (Pulmonata, Stylommatophora) caused by sexual selection? Biological Journal of Linnean Society, 71(4), 599–613. https://doi. org/10.1111/j.1095-8312.2000.tb01280x.
Baur, B. (2010). Stylommatophoran gastropods. En J. L. Leonard y A. Córdoba-Aguilar (Eds.), The Evolution of primary sexual characters in animals (538–552). Oxford University Press.
Baur, B., & Baur, A. (2017). Reproductive strategies in stylommatophoran gastropods. En S. Saleuddin y S. Mukai (Eds.), Physiology of molluscs: a collection of selected reviews (311–377). Apple Academic Press Waretown.
Bosch-Diaz, C. (2021). Variabilidad de la conducta de apareamiento y los órganos genitales de Setipellis stigmatica (L. Pfeiffer, 1841) (Gastropoda: Cepolidae) [Tesis de Maestría, Universidad de La Habana].
Bouchet, P., Rocroi, J. P., Hausdorf, B., Kaim, A., Kano, Y., Nützel, A., Parkhaev, P., Schrödl, M., & Strong, E. E. (2017). Revised classification, nomenclator and typification of gastropod and monoplacophoran families. Malacologia, 61(1–2), 1–526. https://doi. org/10.4002/040.061.0201.
Calcutt, J., Cuezzo, M. G., Jackson, M., & Salvador, R. B. (2020). Phylogenetic relationships and classification of Solaropsidae (Gastropoda: Stylommatophora). Archiv für Molluskenkunde, 149(2), 181–193. https://doi.org/10.1127/arch.moll/149/181-193.
Chase, R. (2007). The function of dart shooting in helicid snails. American Malacological Bulletin, 23(1), 183–189. https://doi.org/10.4003/0740-2783-23.1.183.
Davison, A., & Mordan, P. B. (2007). A literature database on the mating behavior of stylommatophoran land snails and slugs. American Malacological Bulletin, 23(1), 173–181. https://doi.org/10.4003/0740-2783-23.1.173.
Davison, A., Wade, C. M., Mordan, P. B., & Chiba, S. (2005). Sex and darts in slugs and snails (Mollusca: Gastropoda: Stylommatophora). Journal of Zoology, 267(4), 329–338. https:// doi.org/10.1017/S0952836905007648
Eberhard, W. G. (2011). Experiments with genitalia: a commentary. Trends in Ecology and Evolution, 26(1), 17–21. https://doi.org/10.1016/j.tree.2010.10.009.
Eberhard, W. G. (2015). Cryptic female choice and other types of post-copulatory sexual selection. En A. Peretti y A. Aisenberg (Eds.), Cryptic female choice in arthropods (1–26). Springer.
Espinosa, J., & Ortea, J. (1999). Moluscos terrestres del archipiélago cubano. Avicennia, 2, 1–137.
Garefalaki, M. E., Kalyva, S., Janicke, T., & Staikou, A. (2017). Intraspecific variation in reproductive characters is associated with the strength of sexual selection in the hermaphroditic land snail Cornu aspersum. Behavioural Ecology Sociobiology, 71(10), 150–161. https://doi.org/10.1007/s00265-017-2383-4.
Hernández, M. (2015). Mating behaviour in Jeanneretia ss. (Helicoidea: Cepolidae), endemic of the western region of Cuba. Unitas Malacologica Newletter, 35, 7–9.
Hernández, M., Backeljau, T., & Bauzá, M. A. (2021). Genital anatomy, jaw, and radula of the species of the genus Jeanneretia (Helicoidea: Cepolidae), endemic to western Cuba. Archiv für Molluskenkunde, 150, 13–29. https://doi.org/10.1127/arch.moll/150/013-029.
Hernández, M., Bauzá, M. A., & Backeljau, T. (2022). Genital anatomy, jaw and radula of Guladentia subtussulcata (Helicoidea, Cepolidae), endemic to western Cuba. Zookeys, 1080, 99–106. https://doi.org/10.3897/zookeys.1080.73194.
Hernández, M., Bauzá, M. A., Franke, S., & Fernández, A. (2020). A new genus and species of cepolid from Cuba (Pulmonata, Helicoidea). Ruthenica, 30(3), 155–164. https://doi. org/10.35885/ruthenica.2021.30(3).3.
Kimura, K., & Chiba, S. (2015). The direct cost of traumatic secretion transfer in hermaphroditic land snails: individuals stabbed with a love dart decrease lifetime fecundity. Proceedings of Royal Society B, 282(1804), 20143063. https://doi.org/10.1098/rspb.2014.3063.
Kimura, K., & Chiba, S. (2013). Delayed spermatophore removal in the land snail Euhadra peliomphala. Biological Journal of Linnean Society, 108(4), 806–811. https://doi. org/10.1111/bij.12008.
Kimura, K., Chiba, S., & Koene, J. M. (2014). Common effect of the mucus transferred during mating in two dart-shooting snail species from different families. Journal of Experimental Biology, 217, 1150–1153. https://doi.org/10.1242/jeb.095935.
Koene, J. M., & Chiba, S. (2006). The way of the samurai snail. American Naturalist, 168(4), 553–555. https://doi.org/10.1086/508028.
Koene, J. M., & Reyes-Tur, B. (2020). Cuban Cupids: Mating behaviour and physiology of dartpossessing land snails. The Malacologist, 70, 26–27.
Koene, J. M., & Schulenburg, H. (2005). Shooting darts: co-evolution and counter-adaptation in hermaphroditic snails. BMC Evolutionary Biology, 5, 25. https://doi.org/10.1186/14712148-5-25.
Koene, J. M., Jansen, R. F., Ter Maat, A., & Chase, R. (2000). A conserved location for the central nervous system control of the mating behaviour in gastropod molluscs: evidence from a terrestrial snail. Journal of Experimental Biology, 203, 1071–1080. https://doi. org/10.1242/jeb.203.6.1071.
Lange, R., Reinhard, K., Michiels, N. K., & Anthes, N. (2013). Functions, diversity, and evolution of traumatic mating. Biological Reviews, 88, 585–601. https://doi.org/10.1111/brv.12018.
Lodi, M., & Koene, J. M. (2016). The love-darts of land snails: integrating physiology, morphology and behaviour. Journal of Molluscan Studies, 82(1), 1–10. https://doi.org/10.1093/mollus/ eyv046.
Lodi, M., Staikou, A., Janssen, R., & Koene, J. M. (2017). High level of sperm competition may increase transfer of accessory gland products carried by the love dart of land snails. Ecology and Evolution, 7(24), 11148–11156. https://doi.org/10.1002/ece3.3385.
Méndez-Hernández, A. A. (2011). Variabilidad del dardo en especies de moluscos de la familia Cepolidae: implicaciones para la selección sexual [Tesis de Licenciatura, Universidad de Oriente].
Miller, W. B., & Naranjo-García, E. (1991). Familial relationships and biogeography of the western American and Caribbean Helicoidea (Mollusca: Gastropoda: Pulmonata). American Malacological Bulletin, 8(2), 147–153. https://biostor.org/reference/143272.
Nordsieck, H. (1987). Revision des systems der Helicoidea (Gastropoda: Stylommatophora). Archiv für Molluskenkunde, 118(1/3), 9–50. https://doi.org/10.5962/bhl.title.141070.
Nordsieck, H. (2013). Higher classification of Helicoidea (Gastropoda: Stylommatophora) and the molecular analyses of their phylogeny. Disponible en https://www.hnords.de. Último acceso 12–VII–2014.
Nordsieck, H. (2017). Pulmonata, Stylommatophora, Helicoidea: Systematics with comments. ConchBooks, Hackenheim.
Razkin, O., Gómez-Moliner, B. J., Prieto, C. E., Martínez-Ortíz, A., Arrébola, J. R., Muñoz, B., Chueca, L. J., & Madeira, M. O. (2015). Molecular phylogeny of the western Palaearctic Helicoidea (Gastropoda, Stylommatophora). Molecular Phylogenetic Evolution, 83, 99–117. https://doi.org/10.1016/j.ympev.2014.11.014.
Reyes-Tur, B., Allen, J. A., Cuellar-Araujo, N., Hernández, N., Lodi, M., Méndez-Hernández, A. A., & Koene, J. M. (2015). Mating behaviour, dart shape and spermatophore morphology of the Cuban tree snail Polymita picta (Born, 1780). Journal of Molluscan Studies, 81, 187–195. https://doi.org/10.1093/mollus/eyu089.
Reyes-Tur, B., Fernández-Velázquez, A., & Ortiz, Y. (2000). Conducta de apareamiento y aspectos de la relación estructura-función del sistema reproductor en Polymita muscarum Lea 1834, (Gastropoda: Pulmonata). Revista Biología, 14(2), 160–166.
Reyes-Tur B., Gordillo-Pérez, M. J., Bosch-Diaz, C., Rodríguez-Potrony, H., & RodríguezMatos, J. (2020). Apareamiento, espermatóforo y aparato del dardo de Polymita brocheri (Gastropoda: Cepolidae): conducta y morfología. Revista Cubana de Ciencias Biológicas, 8(1), 1–16.
Reyes-Tur, B., & Koene, J. M. (2007). Use of dart apparatus by hermaphroditic land snail Polymita muscarum (Lea, 1834). Animal Biology, 57(2), 261–266. https://doi. org/10.1163/157075607780377974.
Rodríguez-Potrony, H., Bosch-Diaz, C., Gordillo-Pérez, M. J., Rodríguez-Matos, J., & Reyes-Tur, B. (2020). Parámetros reproductivos, historia de vida y crecimiento de Polymita brocheri (Gastropoda: Cepolidae) en condiciones de cautiverio. Poeyana, 510, 10–17.
Schärer, L., & Ramm, S. A. (2016). Hermaphrodites. En R. M. Kliman (Ed.), Encyclopedia of Evolutionary Biology (Vol. 2, 212–224). Elsevier Science Publishing.
Schileyko, A. A. (1991). Taxonomic status phylogenetic relations and system of the Helicoidea sensu lato. Archiv für Molluskenkunde, 120(4/6), 187–236.
Schileyko, A. A. (2004). Treatise on recent terrestrial pulmonate molluscs. Part 12. Bradybaenidae, Monadeniidae, Xanthonychidae, Epiphragmophoridae, Helminthoglyptidae, Elonidae, Humboldtianidae, Sphincterochilidae, Cochlicellidae. Ruthenica, 2, 1627–1763.
Sei, M., Robinson, D. G., Geneva, A. J., & Rosenberg, G. (2017). Doubled helix: Sagdoidea is the overlooked sister group of Helicoidea (Mollusca: Gastropoda: Pulmonata). Biological Journal of Linnean Society, 122(4), 697–728. https://doi.org/10.1093/biolinnean/blx082.
Stewart, M. J., Wang, T., Koene, J. M., Storey, K. B., & Cummins, S. F. (2016). A “love” dart allohormone identified in the mucous glands of hermaphroditic land snails. Journal of Biological Chemistry, 291(15), 7938–7950. https://doi.org/10.1074/jbc.M115.704395.
Tompa, A. S. (1984). Land snails (Stylommatophora). En A. S. Tompa, N. H. Verdonk y J. A. M. van den Biggelaar (Eds.), The Mollusca (Vol. 7, 47–140). Elsevier Science Publishing.
Wilcox, D., Dove, B., McDavid D., & Greer, D. (2002). UTHSCSA Image tool for Windows, version 3.0. University of Texas, Health Science Center.
