INTRODUCCIÓN
Los ofidios constituyen el segundo grupo en importancia ecológica dentro de los reptiles con 3921 especies descritas(Uetz y Hallermann, 2021). Sin embargo, en las Antillas los estudios de ecología de serpientes han sido muy escasos y la mayoría se han realizado con especies de la familia Boidae (Blanco y Fong, 2011). En el 62 % de las especies no se han realizado investigaciones detalladas y no existe información sobre la historia natural de muchos de los taxones (Henderson y Powell, 2009).
Las serpientes cubanas están representadas por 43 especies, de las cuales 39 son endémicas (Hedges, 2018). A ellas pertenecen cuatro familias, de las cuales la de mayor diversidad es Tropidophiidae. Las serpientes del género Tropidophis, conocidas comúnmente como “Boas enanas” presentan una distribución neotropical (Rodríguez-Cabrera et al., 2017). Estas incluyen cinco especies de América del Sur y veintisiete de las islas del Caribe, donde Cuba tiene la mayor diversidad dentro del género con 17 especies (Curcio et al., 2012; Díaz y Cádiz, 2020) y un alto nivel de endemismos (Schwartz y Henderson, 1991). Por lo general el período reproductivo está comprendido entre marzo y septiembre, y en primavera tienden a aumentar la actividad, debido a que ocurren las cópulas. Las hembras pueden tener entre una y quince crías, en dependencia del tamaño y la madurez del animal (Domínguez y Moreno, 2003).
Tropidophis melanurus (Schlegel, 1837), conocida comúnmente como “majá amarillo o bobo”, es considerada como la de mayor tamaño dentro del género, y también la más abundante (Domínguez y Moreno, 2003). Posee una amplia distribución en toda la isla de Cuba, que incluye varios cayos Rodríguez Schettino et al. (2013). Como casi todas las especies de Tropidophis, T. melanurus es una cazadora nocturna (Henderson y Powell, 2009), pero puede estar activa durante el día en lugares sombreados (Rodríguez-Cabrera et al., 2017). Estas serpientes emplean como estrategias de alimentación tanto la búsqueda activa de la presa o forrajeo, como la pasiva de sentarse y esperar, “sit and wait”, (Rodríguez-Cabrera et al., 2017). Los ámbitos de caza frecuentemente se localizan en la vegetación, grandes rocas y construcciones humanas.
El Jardín Botánico de Cienfuegos posee una de las mayores poblaciones de Tropidophis melanurus de toda la región central de Cuba, sin embargo, esta ha sido muy poco estudiada (Rodríguez-Cabrera, com. pers.). De manera general, existen muy pocos estudios poblacionales de la especie (Blanco y Fong, 2011). Se conoce que T. melanurus es de hábitos nocturnos (Henderson y Powell, 2009) pero se desconocen sus patrones de actividad durante distintos momentos de la noche y en los diferentes meses y estaciones del año (Blanco y Fong, 2011).
Existen autores que plantean que las variables climáticas influyen en la actividad de los ofidios (Murphy y Schlager, 2003); mientras que otros manifiestan que dicha actividad es independiente de las variables climáticas y están más influenciados por factores como las necesidades tróficas (Torello-Viera y Marques, 2017). En nuestro caso de estudio si las condiciones climáticas como las precipitaciones y la humedad relativa aumentan, debería incrementarse también la actividad de la especie.
OBJETIVOS
Caracterizar la actividad diaria de Tropidophis melanurus en el Jardín Botánico de Cienfuegos.
Determinar y describir las variaciones en la actividad diaria y el ciclo de actividad anual de Tropidophis melanurus en las estaciones de lluvia y seca en el área.
MATERIALES Y MÉTODOS
El Jardín Botánico de Cienfuegos se encuentra situado a unos 15 km del municipio Cienfuegos, enclavado en áreas aledañas al Central Pepito Tey, en la carretera que conduce a Trinidad. De las 97 hectáreas de las que consta el jardín, 7 son de bosque natural preservado. El centro exhibe una flora tropical leñosa con 1611 especies, 117 familias botánicas y 669 géneros, destacándose el porte arbóreo y arbustivo de sus especies y la madurez de las mismas que le confieren una apariencia de bosque natural (López, 2017). Es el Jardín Botánico más importante de la red de jardines botánicos existente en Cuba por ser el más antiguo y poseer las colecciones de plantas más completas. Fue declarado Monumento Nacional el 20 de octubre de 1989.
Se realizaron recorridos al azar de 1km de largo por cuatro metros de ancho que abarcaron la zona desde la entrada del Jardín Botánico hasta el Ranchón, teniendo en cuenta no repetir el mismo recorrido todo el tiempo de muestreo en esa noche. Esta técnica de muestreo ha demostrado ser la más efectiva para el muestreo de ofidios según Cacciali (2013). Los muestreos se realizaron desde las 7:00 p.m. hasta las 6:00 a.m. y se estandarizaron a una hora de duración con intervalos del mismo tiempo entre cada muestreo. Este horario se seleccionó debido a que T. melanurus, como casi todas las especies del género es una cazadora nocturna (Henderson y Powell, 2009). Las visitas al área de estudio se realizaron con una frecuencia mensual, extendiéndose durante un año en el período comprendido entre abril del 2018 hasta marzo del 2019.
Se contaron en cada recorrido todos los individuos de la especie y se tomaron datos de la longitud total (LT), el sexo, el estado de actividad del animal, así como el sustrato y/o refugio en el que se encontraban. Para medir la LT del animal, se utilizó una cinta métrica de 1 metro y medio de longitud y se midió desde la punta de la cabeza hasta la punta de la cola. Para determinar el sexo, se ejerció una ligera presión con el dedo pulgar justo debajo de la cloaca y se observó si se proyectaban o no los hemipenes. El estado de actividad se dividió en activo e inactivo, y se tomaron como inactivos aquellos individuos que se encontraban ocultos o parcialmente ocultos en algún refugio. Se tomó como refugio aquellas oquedades, grietas o agujeros en troncos y rocas donde se avistaron individuos escondidos que no mostraban ningún tipo de actividad. La variable sustrato se dividió en tronco, curujey, roca, hojarasca y suelo.
Los datos de actividad diaria fueron agrupados en grupos de 2 meses para facilitar su análisis teniendo representados todos los momentos de la noche en un mismo gráfico. Para demostrar que los datos tenían una distribución normal se utilizó la prueba de Kolmogorov-Smirnov. Para comparar la abundancia de la especie entre épocas climáticas (seca y lluvia) se utilizó la prueba chi cuadrado (X2). La estación lluviosa inicia en mayo y finaliza en octubre; mientras que la época de seca abarca desde noviembre hasta abril. El nivel de significación empleado en la prueba chi cuadrado (X2) fue del 5 %. Los datos estadísticos fueron procesados en el software Statistica V10.0.
RESULTADOS
De los 271 avistamientos de individuos en el estudio, 240 estaban sobre el sustrato tronco, 7 sobre curujey, 5 sobre rocas, 11 en la hojarasca y 8 fueron vistos en el suelo. Los individuos machos fueron más abundantes en todos los meses que las hembras, con un 65 % del total de individuos observados. Durante el año de muestreo solo se observaron 2 juveniles y la media de LT de todos los individuos fue 55 cm.
Se encontró un mayor número de individuos activos que inactivos en la mayoría de los recorridos nocturnos. Se registró un total de 137 individuos activos durante la estación de seca y 134 individuos activos durante la estación de lluvia, por lo que se puede decir que la actividad se mantuvo muy semejante en ambas estaciones. Los horarios en que se registraron los mayores números de individuos activos durante el año de muestreo fueron los comprendidos en los recorridos de 8 p.m. a 1 a.m., con 34 a 36 individuos, generalmente.
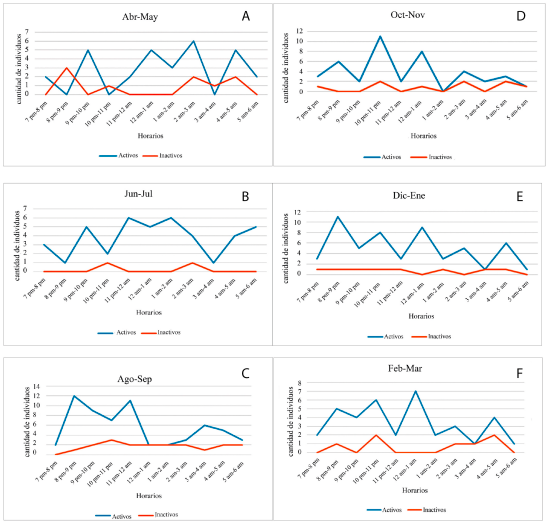
En los meses de abril y mayo (Fig. 1A) se puede observar la existencia de 4 picos de alta actividad en los horarios de 9-10 p.m., 12-1 a.m., 2-3 a.m. y 4-5 a.m. También, se aprecian 3 picos de baja actividad donde no se avistaron individuos activos en los horarios de 8-9 p.m., 10-11 p.m. y 3-4 a.m. Además, se observó un promedio de tres individuos activos por noche para estos meses. En el caso de los avistamientos de individuos inactivos se mantienen en bajo número y relativamente constante, excepto en los horarios comprendidos entre las 7-8 p.m., 9-10 p.m., 11 p.m. y las 2 a.m., así como de 5-6 a.m. donde no se avistó ningún individuo inactivo.
Los datos recopilados en junio y julio (Fig.1B) arrojaron una alta actividad de manera general, destacándose 2 picos de máxima actividad en los horarios de 11-12 a.m. y 1-2 a.m. Hubo 2 picos de actividad mínima donde solo se avistó un ejemplar activo en los horarios de 8-9 p.m. y 3-4 a.m. La media de avistamientos de individuos activos en este periodo fue de 4 aproximadamente. Además, solo se avistaron 2 individuos inactivos, uno de ellos en el horario de 10-11 p.m. y otro en el horario de 2-3 a.m. Entre los pares de meses junio-julio y abril-mayo no se encontraron diferencias estadísticas significativas entre la cantidad de avistamientos de individuos activos (= 24.44, p = 0.2235) ni entre los avistamientos de individuos inactivos (= 4.27, p = 0.2329).
Agosto y septiembre (Fig. 1C) por su parte, presentaron 2 picos marcados de alta actividad en los horarios de 8-9 p.m. y 11-12 a.m. También existe un descenso de la actividad en el horario de 12-1 a.m., que se mantiene hasta el horario de las 3-4 a.m. donde ocurre un incremento de ejemplares activos. En esta ocasión, la media de avistamientos individuos activos observados fue de 6 aproximadamente. Los individuos inactivos avistados se mantuvieron entre 0 y 3 individuos a lo largo de la noche. Entre los pares de meses agosto-septiembre y abril-mayo no se encontraron diferencias significativas entre la cantidad de avistamientos de individuos activos (= 24.44, p = 0.6578) ni entre los avistamientos de individuos inactivos (= 14.27, p = 0.1129). Además, al comparar los pares de meses agosto-septiembre y junio-julio, tampoco se arrojaron diferencias estadísticas significativas entre la cantidad de individuos activos (= 36.97, p = 0.3779) ni entre los individuos inactivos (= 5.23, p = 0.1551).
Figura 1. Actividad diaria de Tropidophis melanurus registrada durante todos los meses de muestreo en el Jardín Botánico de Cienfuegos. A, abril y mayo del 2018; B, junio y julio del 2018; C, agosto y septiembre del 2018; D, octubre y noviembre del 2018; E, diciembre del 2018 y enero del 2019; F, febrero y marzo del 2019.
Los meses, de octubre y noviembre, (Fig. 1D), tienen la peculiaridad de mantener la actividad muy variable, encontrándose 2 picos de actividad en los horarios de 10-11 p.m. y 12 m.-1 a.m. Se registró también un pico de 0 actividad en el horario de 1 a.m.-2 a.m. La media de individuos activos avistados fue de 6 aproximadamente al igual que en los 2 meses anteriores.
De igual manera, los avistamientos de individuos inactivos se mantuvieron en cantidades bajas y constantes en cada horario. Cabe resaltar que luego de comparar octubre-noviembre tanto con el par de meses de agosto-septiembre, como con el par junio-julio no se mostraron diferencias significativas en la cantidad de individuos activos: 16.87, p = 0.1332, y 26.67, p = 0.2164. De igual manera ocurrió con los resultados de las comparaciones entre los mismos pares de meses pero para individuos inactivos: 46.12, p = 0.2136, y 32.77, p = 0.4323.
Por otro lado, en los meses de diciembre y enero (Fig. 1E) se observa un marcado comportamiento en zigzag de la actividad. Existió un máximo de actividad con 11 avistamientos en el horario de 8-9 p.m. y un mínimo de actividad con 1 avistamiento en el horario de 3-4 a.m. La media de avistamientos de individuos activos se vuelve a repetir, manteniéndose alrededor de 6. Como en los meses anteriores, los individuos inactivos observados se mantienen en bajos números. Tras aplicar la prueba estadística entre los pares de meses octubre-noviembre y diciembre-enero, no se encontraron diferencias significativas entre la cantidad de individuos activos (= 48.88, p = 0.2159) ni entre los avistamientos de individuos inactivos (= 4.27, p = 0.1177). De igual forma sucedió al comparar los pares de meses diciembre-enero y agosto-septiembre, para los individuos activos (= 28.11, p = 0.1339) y para los inactivos (= 5.78, p = 0.1228). Además, al comparar los pares de meses diciembre-enero con junio-julio y con abril-mayo, respectivamente, tampoco se arrojaron diferencias estadísticas significativas entre la cantidad de individuos activos: 16.44, p = 0.1422, y 4.76, p = 0.1882; ni entre los individuos inactivos: 4.86, p = 0.1466, y 21.34, p = 0.2336.
En los meses de febrero y marzo (Fig. 1F) se observan 4 picos de una mayor actividad en los horarios de 8-9 p.m., 10-11 p.m., 12-1 a.m. y 4-5 a.m. Los picos de mínima actividad ocurrieron en los horarios de 3-4 a.m. y 5-6 a.m. en los cuales solo se avistó un individuo activo. En estos meses, la media fue de 4 individuos activos avistados. Los ejemplares inactivos avistados se mantuvieron en números bajos, apareciendo un máximo de 2 avistamientos en los horarios de 10-11 p.m. y 4-5 a.m. Entre los pares de meses octubre-noviembre y febrero-marzo no se encontraron diferencias significativas entre la cantidad de individuos activos avistados (= 51.63, p = 0.1463) ni entre los avistamientos de individuos inactivos (= 9.28, p = 0.0542). Además, al comparar los pares de meses diciembre-enero y febrero-marzo tampoco se evidenciaron diferencias estadísticas significativas entre la cantidad de individuos activos (= 57.75, p=0.0121) ni entre los individuos inactivos avistados (= 0.91, p = 0.6323). Asimismo ocurrió al comparar febrero marzo con agosto-septiembre y con junio-julio. En el primer caso los resultados de la prueba para individuos activos fueron de (= 42.36, p = 0.5244) y para los inactivos (= 0.62, p = 0.3622); mientras que para la comparación con junio-julio los individuos activos e inactivos arrojaron valores igualmente no significativos: 34.71, p = 0.2824, y 24.11, p = 0.4823.
El ciclo anual de actividad durante el año de estudio se muestra en la Figura 2, donde, en los meses de agosto-septiembre se avistaron hasta 12 individuos y en los meses de abril-mayo y octubre-noviembre no se avistaron individuos en algunos recorridos. La media anual de avistamientos fue de 4. Cabe resaltar que los mayores valores de individuos observados comprendieron los períodos de finales de la temporada lluviosa e inicios de la temporada seca. Además, no existen diferencias de significación entre los individuos activos avistados durante los meses del periodo de seca y durante los del periodo lluvioso (= 92.95, p = 0.6784).
Figura 2. Avistamientos de individuos activos de Tropidophis melanurus registrados entre los meses de abril del 2018 y marzo del 2019 en el Jardín Botánico de Cienfuegos.
El comportamiento de los individuos inactivos a lo largo del año de muestreo (Fig. 3) se mantiene en muy bajos números, llegándose a observar un máximo de 3 avistamientos en los meses de abril-mayo y agosto-septiembre. Sin embargo, la media de individuos inactivos observados en el año de estudio fue de solo uno por mes. Además, se aprecia que en todos los meses dentro del período de muestreo existieron horarios donde no se advirtió inactividad en la especie. Tras comparar los avistamientos de individuos inactivos con la prueba estadística, no mostraron diferencias significativas entre los meses del periodo de seca y de lluvia (= 11.13, p = 0.0844).
Figura 3. Avistamientos de individuos inactivos de Tropidophis melanurus registrados entre los meses de abril del 2018 y marzo del 2019 en el Jardín Botánico de Cienfuegos.
DISCUSIÓN
Los números de individuos manejados en este estudio solo pueden ser usados para medir la actividad de la especie en el lugar, sería incorrecto emplearlos para estimar el tamaño de la población u otros parámetros. Esto se debe a que un mismo ejemplar pudo haber sido contado en varios meses, incluso puede haber sido registrado el mismo individuo más de una vez (en menor medida) en una misma noche. El hecho de que haya sido divisado un número mucho mayor de individuos activos que inactivos en los horarios trabajados es debido a que esta especie posee una actividad mayoritariamente nocturna (Henderson y Powell, 2009). Los horarios más tempranos de la noche, donde se observaron más individuos coincide con lo encontrado por Torello-Viera y Marques (2017) para las especies Apostolepis assimilis (Reinhardt, 1861) y Dipsas mikanii (Schlegel, 1837). Como plantean los mismos autores, esto puede deberse a que en dicho horario la temperatura es más cálida que en el resto de la madrugada, lo que favorecería la actividad.
La elevada cantidad de individuos avistados en el sustrato tronco puede ser debido, a que la especie prefiere utilizar los troncos de mediana altura de los árboles existentes en el área para cazar. Por otra parte, por las características del área de estudio y la elevada vegetación se dificultaba mucho la observación de individuos en el suelo, por tal razón, los individuos que se encontraban sobre troncos a una mediana altura eran más fáciles de ser observados. De igual forma, el bajo número de individuos juveniles avistados puede corresponder a su pequeño tamaño y dificultad para visualizarlos, y no necesariamente significar que los individuos adultos y más grandes presentan una actividad mucho mayor en el área.
La disminución de la actividad de la especie al acercarse el amanecer y el aumento al caer la noche coincide con lo observado por Blanco y Fong (2011) los cuales realizaron un trabajo donde analizaban la actividad diurna de Tropidophis melanurus y obtuvieron que existía mayor actividad en las primeras horas de la mañana y en el crepúsculo. Además, el 65 % de los individuos que avistaron eran inactivos, mientras que en el presente trabajo el número de individuos inactivos avistados fue solo del 15 %. Esto último corrobora lo planteado por Domínguez y Moreno (2003) y Henderson y Powell (2009) que afirman que la especie es mayoritariamente nocturna, aunque pueden verse algunos individuos durante las horas del día. Es válido aclarar, que los números de individuos activos manejados por Blanco y Fong (2011) son muy inferiores a los encontrados en este trabajo, lo cual puede deberse a la hora del día en que fue realizado y a la diferencia en la densidad poblacional existente entre los lugares elegidos para realizar los estudios.
En los meses de abril-mayo ocurrieron precipitaciones durante las primeras horas de la noche y se registraron 30 individuos, lo que constituye el menor número de Tropidophis melanurus activos, si lo comparamos con la media de entre 34 y 36 animales por noche. Por otro lado, la mayor cantidad de observaciones ocurrieron después de las 12:00 a.m., cuando ya había terminado la lluvia, lo que difiere con el patrón general registrado durante el año, del mayor número de avistamientos encontrados durante las primeras horas de la noche. Este comportamiento de una mayor actividad seguida de la lluvia, coincide con lo ocurrido durante el muestreo realizado en septiembre. En este mes llovió en horas de la tarde y durante las primeras horas del muestreo se registró la mayor actividad de la especie; además coincide con lo expresado por Carl et al. (2012).
En los muestreos realizados durante los meses de junio-julio existía una elevada temperatura, alrededor de 28 °C. No obstante, los números de individuos activos son muy similares a los encontrados durante los meses más fríos del año como diciembre-enero, durante los cuales se registró incluso una mayor actividad. Esto pudiera indicar que para esta especie, y en el área de estudio, la temperatura no constituye un factor de relevante importancia en la actividad, y la misma puede estar influenciada por factores como la abundancia de sus recursos tróficos o la búsqueda activa de pareja.
En contraste con los meses de abril-mayo, durante agosto-septiembre se registró la mayor cantidad de avistamientos de individuos activos, incluso duplicando en número a los muestreados durante los meses citados con anterioridad. Por ello, se supone que en el lugar de estudio, la ocurrencia de precipitaciones pudiera determinar el momento en el que ocurre la actividad de la especie, pero no determina una mayor o menor cantidad de individuos activos. Lo anterior, pudiera deberse al aumento de la actividad de las presas de la especie durante los meses donde aumentan las precipitaciones.
Los meses de octubre-noviembre también presentaron un elevado número de avistamientos, solo superado por el par de meses anteriores. Sin embargo, casi la totalidad de los individuos observados en estos meses se encontraban sobre el sustrato tronco, por lo que las condiciones de vegetación elevada en el terreno antes mencionadas pueden haber influido con mayor fuerza sobre el número de individuos observados en estos meses. Además, la propia coloración y tamaño promedio de la especie y de la generalidad de los individuos encontrados en este estudio, pudiesen aumentar las posibilidades de visualización en el área.
Durante los meses de febrero-marzo fue donde único se observaron individuos alimentándose de ranas, a pesar de no existir en el área demasiada humedad, como en otros meses. Quizás, esto se debe a que la especie priorice la alimentación durante este tiempo, con vistas a prepararse para la temporada de cópulas en los meses siguientes. Investigaciones como las de Allen y Ullrey (2004) han demostrado que la alimentación en reptiles es crucial para el desarrollo de óvulos y espermatozoides así como para el correcto desarrollo de los embriones.
De manera general, la actividad de la especie en el área de estudio es contraria a lo esperado, pues presenta los menores números de avistamientos en los meses de abril-mayo y junio-julio. Esto difiere con lo expresado por Domínguez y Moreno (2003) pues según estos autores, la actividad de la especie debía aumentar durante la primavera por ser esta la temporada de cópulas. Por otro lado, el hecho de que el mayor número de avistamientos haya podido observarse en los meses que comprenden el final de la temporada de lluvia y el inicio de la temporada de seca puede ser relevante por dos razones. Primeramente, por las propias condiciones climáticas de estos meses, o bien, por estar comprendido este periodo dentro de su etapa reproductiva, que se extiende de marzo a septiembre. Esto último es explicado por (Murphy y Schlager, 2003), que plantean que en muchas serpientes los patrones de actividad anuales están estrechamente relacionados con los ciclos ováricos y testiculares o con los periodos de cortejo y cópula.
Por otro lado, el hecho de que el factor temperatura no haya influido en la actividad de la especie en el área de estudio, coincide con lo planteado por (Vitt y Caldwell, 2014) acerca de que alternativamente podría ocurrir una intensa actividad con independencia de la temperatura siempre que esta actividad traiga una ganancia importante para el animal. Contrario a esto (Murphy y Schlager, 2003), indican que en varias especies los patrones de actividad cambian con la temperatura media diaria. Thamnophis radix y algunas serpientes de cascabel son diurnas durante las bajas temperaturas de la primavera temprana y el otoño tardío, pero durante los días más calurosos del verano estas se vuelven nocturnas.
Los bajos avistamientos de individuos inactivos de manera general a lo largo del año de muestreo, pueden deberse al horario en que se realizó este trabajo, teniendo en cuenta la condición nocturna de la especie. Albrecht y Gotelli (2001) expresan que los patrones de actividad diaria pueden estar influenciados por una variedad de factores tales como la estación del año, la evasión de depredadores, la biogeografía y la influencia antropogénica. Varios de estos factores serían plausibles para explicar los bajos números de individuos inactivos en el área de estudio durante los horarios nocturnos de muestreo, debido a que tanto por la acción del hombre, como por la de especies exóticas que fungen como mascotas, los individuos de T. melanurus incrementarían su inactividad en los horarios diurnos donde los factores antes mencionados representarían un mayor impacto para ellos.
También, la media reducida de individuos inactivos puede estar dada por la dificultad de los mismos para ser observados, debido a tomarse como inactividad de estos, que estuviesen ocultos en sus refugios. Asimismo, varios de los individuos inactivos observados parecían haber ingerido alimento hacia poco tiempo, por lo que lo que se tomó como inactividad en este trabajo, pudiera deberse a que se encontraban en estado postprandial.
CONCLUSIONES
Las primeras horas de la noche son las de mayor actividad para Tropidophis melanurus en el Jardín Botánico de Cienfuegos durante el tiempo de muestreo. La actividad anual de la especie tuvo su pico máximo durante finales de la temporada de lluvia y principios de la temporada de seca. Por consiguiente, el periodo de menor actividad fue a finales de la temporada de seca e inicios de la temporada lluviosa. No obstante, la actividad de la especie en los periodos de lluvia y seca fue muy semejante. Además, se comprobó que los eventos de precipitaciones pueden afectar el momento de actividad de la especie, pero no la cantidad de individuos activos. La temperatura parece no ser un factor de relevante importancia en la actividad de la especie dentro del área de estudio y el periodo estudiado.
AGRADECIMIENTOS
Se agradece a todo el personal científico y de vigilancia del Jardín Botánico de Cienfuegos por permitirnos el acceso al área. Además, quisiéramos agradecer a Tomás Michel Rodríguez Cabrera (Sociedad Cubana de Zoología) y al Dr. C. Ángel Arias Barreto (Centro de Estudios y Servicios Ambientales de Villa Clara), por sus revisiones y aclaraciones para la conformación final de este documento.
Literatura Citada
Albrecht, M. y N. J. Gotelli. 2001. Spatial and temporal niche partitioning in grassland ants. Oecologia, 126 (1): 134-141.
Allen, M. E.y D. E. Ullrey. 2004. Relationships among nutrition and reproduction and relevance for wild animals. Zoo Biology, 23 (6): 475-487.
Blanco, J. y A. Fong. 2011. Hábitat, Actividad diurna y morfometría de cuatro especies de ofidios (Reptilia: Squamata) de Cuba. Novitates Caribaea, (4): 91-99.
Cacciali, P. 2013. Diversidad y selección de hábitat de la fauna de serpientes en Kangüery (área para parque San Rafael). Boletín del Museo Nacional de Historia Natural de Paraguay, 17 (1): 29-39.
Carl, H. E., M. O. John, R. C. Terry, F. L. Arndt y D. H. Traci. 2012. Annual and daily activity cycles of snakes in northern Virginia, USA. Herpetological Bulletin, 121 (5): 23-28.
Curcio, F. F., P. M. Sales, A. J. Suzart y M. Trefault. 2012. Taxonomy of the South American dwarf boas of the genus Tropidophis Bibron, 1840, with the description of two new species from the Altlantic Forest (Serpentes: Tropidophiidae). Herpetological Monographs, 26: 80-121.
Díaz, L. M. y A. A. Cádiz. 2020. New species of Tropidophis (Squamata: Tropidophiidae) and molecular phylogeny of the Cuban radiation of the genus. Novitates Caribaea, 16: 1-19.
Domínguez, M. y L. V. Moreno. 2003. Serpientes del suelo, en Anfibios y Reptiles de Cuba, pp. 98-109.
Hedges, B. 2018. Caribherp Amphibians and Reptiles of Caribbean Islands [en línea][Consulta].
Henderson, R. W.y R. Powell. 2009. Natural History of West Indian Reptiles and Amphibians, Ed. Univ. Press Florida, Gainesville, 496 pp.
López, L. G. 2017. Propuesta de acciones estratégicas para el logro de sinergismos agroecológicos entre el agroecosistema Jardín Botánico de Cienfuegos y agroecosistema municipal, Tesis de Maestría. Universidad Carlos Rafael Rodríguez de Cienfuegos, 87 pp.
Murphy, J. B. y N. Schlager. 2003. Grzimek’s Animal Life Encyclopedia, Ed. Gale Group, Farmington Hills, 571 pp.
Rodríguez Schettino, L., C. A. Mancina y V. Rivalta. 2013. Reptiles of Cuba: Checklist and Geographic Distribution. Smithsonian Herpetological Information Service, 144: 1-98.
Rodríguez-Cabrera, T. M., J. Rosado, R. Marrero y J. Torres. 2017. Birds in the Diet of Snakes in the Genus Tropidophis (Tropidophiidae): Do Prey Items in Museum Specimens Always Reflect Reliable Data? Reptiles & Amphibians, 24 (1): 61-64.
Schwartz, A.y R. W. Henderson. 1991. Amphibians and reptiles of the West Indies: descriptions, distributions, and natural history, Ed. University of Florida Press, Gainesville, 720 pp.
Torello-Viera, N. F. y O. A. V. Marques. 2017. Daily Activity of Neotropical Dipsadid Snakes. South American Journal of Herpetology, 12 (2): 128-135.
Uetz, P. y J. Hallerman. 2021. New species and updates. The Reptile Database.reptarium.cz [en línea].
Vitt, L. J. y J. P. Caldwell. 2014. Herpetology, An Introductory Biology of Amphibians and Reptiles. Elsevier 4ta, Oklahoma, 147 pp.