El género Callinectes Stimpson, 1860 cuenta actualmente con 15 especies descritas (WoRMS, 2020). Son abundantes en lagunas costeras, estuarios y otros ambientes marinos someros asociados a esos sistemas y se encuentran en una amplia variedad de hábitats a lo largo de su ciclo de vida (Yáñez-Arancibia y Day, 1988). Las especies de este género están distribuidas a lo largo del Atlántico neotropical, oeste del Pacífico tropical y la costa oeste de África (Williams, 1974; López-Martínez et al., 2014). Callinectes es un género de aguas cálidas y no se encuentra en aguas con temperatura inferior a 20 °C (Norse, 1977; Guillory et al., 2001). Los patrones de distribución parecen estar condicionados por factores como la salinidad, sobre todo en el Caribe, dentro y entre islas (Norse, 1972, 1977, 1978; Gómez et al., 2009). En el caso de México, la “jaiba prieta” Callinectes rathbunae y la “jaiba gringa” o “cangrejo azul” Callinectes sapidus son las principales especies que soportan la pesquería comercial de cangrejos en México (Chávez y Fernández, 1976; Álvarez y Calderón, 1996).
Se ha estimado que más del 90 % de la captura total consumida en el país proviene de las lagunas costeras de los estados de Veracruz y Tamaulipas (Chávez y Fernández, 1976; Cházaro-Olvera et al., 2000). Un aspecto importante en la historia de vida de las jaibas es el parasitismo causado por Rhizocephala, este es uno de los factores bióticos que afectan a las poblaciones en el golfo de México, debido a su alta prevalencia y periodicidad (Wardle y Tirpak, 1991; Lorán et al., 1993).
Rhizocephala es un superorden de balanos parásitos altamente especializados, restringidos a hospederos crustáceos, entre los que se encuentran decápodos, cumáceos, isópodos, estomatópodos y balanos (Høeg, 1995; Høeg y Lützen, 1995; Walker, 2001).
Entre los efectos causados por estos parásitos a sus hospederos, se encuentran los siguientes: castración parasítica, feminización de los machos, hiperfeminización en hembras, inhibición del proceso de muda, parálisis de los apéndices natatorios (en el caso de Callinectes), y cambios de comportamiento (Reinhard, 1950, 1956; O’Brien yVan Wyk, 1985; Høeg, 1995; Høeg y Lützen, 1995; Álvarez y Calderón, 1996; Vázquez-López et al., 2006; Vázquez-López y Álvarez, 2008; Vázquez-López, 2010).
Rhizocephala tiene un complicado ciclo de vida con una etapa endoparasítica y otra ectoparasítica, la primera es conocida como “interna”, vive dentro del hospedero, y al desarrollarse produce un intrincado sistema de raíces que sirve para absorber nutrientes del hemocele del hospedero (Høeg y Lützen, 1995). La fase ectoparasítica es conocida como “externa”, que en la mayoría de las especies está situada en el pleon del hospedero, está revestida con una cutícula flexible. Consiste en un manto, una cavidad del manto que aloja la masa de huevos del parásito, y la masa visceral que contiene el ovario (Høeg, 1995; Walker, 2001; Noever et al., 2016).
En la mayoría de las especies de rizocéfalos la regla es la ocurrencia de un solo parásito por hospedero, pero en una muestra suficientemente representativa aparecerán infecciones dobles y tal vez triples infecciones; el otro extremo de la escala está representada por unas pocas especies con un constante gran número de externas (Høeg, 1995).
El objetivo del presente estudio fue proporcionar información reciente sobre el número de externas presentes por hospedero en cangrejos de la especie C. rathbunae. El Sistema Lagunar de Alvarado se localiza en la región sureste del estado de Veracruz, México. Está formado de norte a sur por las lagunas Camaronera, Buen País, Alvarado, y Tlalixcoyan y está separado del golfo de México por una barra arenosa. Se localiza en las coordenadas geográficas 18º44’00” y 18°52’5” N, y 95º44’00” y 95º57’00” W (Flores-Coto y Méndez, 1982; Raz-Guzmán et al., 1992; Franco-López, 2017), (Fig. 1).
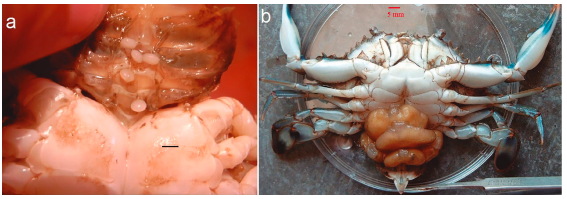
Se capturaron tres cangrejos del género Callinectes parasitados con el rizocéfalo L. texanus. Estos fueron obtenidos de una captura comercial realizada el primero de marzo de 2019. Los organismos fueron capturados con trampas artesanales conocidas localmente como ‘aro jaibero’. En estas artes de pesca se utilizan comúnmente pescado o pequeños racimos de ostras maceradas como carnada. Los especímenes (dos machos y una hembra) correspondieron a la especie C. rathbunae. Uno de los machos exhibió dos externas vírgenes, la hembra exhibió cinco externas vírgenes (Fig. 2a), y el otro macho exhibió cinco externas maduras (Fig. 2b). Se sabe que las externas vírgenes no han sido fecundadas, por lo que no producen huevos o larvas y son de tamaño pequeño, de color blanquecino mientras que las externas maduras los producen periódicamente y son relativamente de mayor tamaño presentando una coloración amarilla (Wardle y Tirpak, 1991; Høeg, 1995; Høeg y Lützen, 1995; Vázquez-López et al., 2006). Cabe destacar que los individuos parasitados no son colectados comercialmente debido a que no alcanzan la talla de captura, que en el caso de C. rathbunae va de 88 a 118 mm en la laguna de Alvarado (Lorán et al., 1993), por lo que son devueltos a la laguna.
Se ha observado que L. texanus habita principalmente en el golfo de México; impactando a las poblaciones de cangrejos del género Callinectes en las lagunas costeras que se encuentran a lo largo del golfo, hasta el momento se han realizado estudios en las partes oriental y norte (Daugherty, 1952; Park, 1969; Adkins, 1972; Wardle y Tirpak, 1991; Hochberg et al., 1992) correspondientes a Estados Unidos. En el caso de México, Lázaro-Chávez et al. (1996) registraron la presencia del parásito en la laguna de Tamihaua, en el estado de Veracruz; Álvarez y Calderón (1996) reportaron la presencia de L. texanus parasitando a C. rathbunae en las lagunas de Casitas, Mandinga y Sontecomapan, en Veracruz, laguna Machona en el estado de Tabasco y lagunas de Atasta y Términos en el estado de Campeche. Álvarez et al. (1999) reportaron la presencia de L. texanus parasitando a C. rathbunae y C. sapidus en la laguna de Alvarado, Veracruz. Se ha estimado que la prevalencia de hospederos infectados varia a lo largo del año, de 3.0 % en julio a 51.5 % en octubre en C. sapidus (Lázaro-Chávez et al., 1996), y de 1.64 % en febrero a 59.69 % en mayo en la especie C. rathbunae (Lorán et al., 1993; Álvarez et al., 1999). Se sabe que el número de externas presentes por hospedero en ambas especies va de una a cuatro (Reinhard, 1950; Wardle y Tirpak, 1991; Lorán et al., 1993; Álvarez y Calderón, 1996; Lázaro-Chávez et al., 1996; Álvarez et al., 1999; Vázquez-López et al., 2006; Vázquez-López y Álvarez, 2007; Vázquez-López et al., 2009).
Recientemente, Vázquez-López et al. (2020) también han mencionado que el número de externas presentes en C. rathbunae es de una a cuatro. Estos autores argumentan que existe una relación directa entre el grado de desarrollo de la externa y el comportamiento del hospedero. Observaron que los cangrejos que exhiben externas vírgenes son más agresivos que los hospederos que presentan externas maduras. En la literatura solo se ha encontrado el estudio realizado por Pearse (1952) en donde se hace referencia de cinco externas en especímenes de la especie C. sapidus, sin dar más detalles, por lo que el presente reporte es el primero en donde se presenta evidencia de cinco externas del balano rizocéfalo L. texanus en su hospedero C. rathbunae. La importancia de esta observación radica en el hecho de que se sabe que la presencia de este parásito representa una gran carga metabólica para su hospedero.
En concordancia con lo anterior, Robles et al. (2002), argumentan que cuando C. rahbunae es parasitada por L. texanus, la respuesta ormorregulatoria de esos cangrejos puede ser afectada debido a la talla y posición del parásito. Los mismos autores mencionan que la morfología de L. texanus carece aparentemente de estructuras que intervengan en la osmorregulación; L. texanus puede reducir la capacidad de C. rathbunae para ajustarse a entornos fluctuantes, provocando que el hospedero incremente su gasto energético, el cuál puede medirse a través de la tasa de consumo de oxígeno.
Autores como Vivarès y Cuq (1981), Haye y Ojeda (1998) y Zetlmeisl et al. (2011), mencionan que varios estudios en crustáceos han confirmado que la presencia de parásitos suele aumentar la tasa metabólica general o disminuir el crecimiento de los hospederos.
Al respecto, Vázquez-López et al. (2006, 2020) y Vázquez-López (2010), observaron que organismos de la especie C. rathbunae que exhibieron externas inmaduras de L. texanus mostraron un comportamiento más agresivo que los hospederos que exhibieron externas maduras; también observaron que los cangrejos con cuatro externas maduras son más sensibles a cambios de salinidad y temperatura, mientras que los hospederos con una externa virgen presentan un comportamiento similar a los cangrejos sanos de la misma especie respecto a cambios en estos parámetros. Los mismos autores han observado que en los muestreos es más común capturar cangrejos con una externa madura que hospederos con cuatro externas maduras. Robles et al. (2002), mencionan que los cangrejos con parásitos maduros presentaron tasas de consumo de oxígeno significativamente más altas que los cangrejos sanos de la misma especie, que la energía extra gastada podría utilizarse para el mantenimiento de la externa del parásito, ya que es una masa adicional que depende del hospedero para alimentación y el cuidado de la externa. Los mismos autores afirman que la energía adicional gastada puede ser utilizada en la regulación osmótica, ya que estos parásitos pueden estar operando como un canal abierto que conecta el exterior con los tejidos y órganos internos del hospedero. Esto puede explicar por qué es más común capturar cangrejos con una o dos externas maduras que organismos con tres y cuatro externas maduras y menos probable capturar cangrejos con cinco externas maduras.
En conclusión, la prevalencia de cangrejos exhibiendo cinco externas es muy baja debido a que los hospederos infectados con cinco parásitos son los más sensibles a los cambios diarios de la temperatura y salinidad puesto que la presencia de estos parásitos representa una carga metabólica extra, la que se incrementa con el desarrollo de los mismos. Este es el primer reporte donde se muestra evidencia de cinco externas en hospederos de la especie C. rathbunae.
Figura 1. Sitios de captura en el Sistema Lagunar de Alvarado, Veracruz, México.
Figura 2. Especímenes de C. rathbune parasitados por L. texanus. a) hembra exhibiendo cinco externas vírgenes, barra de escala 5 mm; b) macho exhibiendo cinco externas maduras, barra de escala 5 mm.
AGRADECIMIENTOS
El autor agradece la valiosa ayuda de la doctora Olga M. Korn de la Academia Rusa de Ciencias, del doctor Jack O’Brien de la Universidad del Sur de Alabama y del doctor Sergio Cházaro-Olvera de la Facultad de Estudios Superiores Iztacala, UNAM por sus valiosos comentarios.
Literatura Citada
Adkins, G. 1972. Notes on the occurrence and distribution of the rhizocephalan parasite (Loxothylacus texanus Boschma) of blue crabs (Callinectes sapidus Rathbun) in Louisiana estuaries. Louisiana Wildlife and Fisheries Commission, Technical Bulletin 2, 1-13 pp.
Álvarez, F. y J. Calderón. 1996. Distribution of Loxothylacus texanus (Cirripedia: Rhizocephala) parasitizing crabs of the genus Callinectes in the southwestern Gulf of Mexico. Gulf Research Reports, 9: 205-210. https://doi.org/10.18785/grr.0903.08
Álvarez, F., A. Gracia, R. Robles y J. Calderón. 1999. Parasitization of Callinectes rathbunae and Callinectes sapidus by the rhizocephalan barnacle Loxothylacus texanus in Alvarado Lagoon, Veracruz, Mexico. Gulf Research Report, 11: 15-21. https://doi.org/10.18785/grr.1101.04
Chávez, E. y M. Fernández. 1976. Contribución al conocimiento de la biología de la jaiba prieta (Callinectes rathbunae, Decapoda Portunidae) del estado de Veracruz. Revista de la Sociedad Mexicana de Historia Natural, 37: 273-292.
Cházaro-Olvera, S., A. Rocha-Ramírez y R. Román-Contreras. 2000. Observations on feeding, maturity, and fecundity of Callinectes similis Williams, 1966, on the central continental shelf off Veracruz, Gulf of Mexico. Crustaceana, 73: 323-332. https://doi.org/10.1163/156854000504417
Daugherty, F. M. 1952. The blue crab investigation, 1949-50. Texas Journal of Science, 4: 77-84.
Flores-Coto, C. y M. L. V. Méndez. 1982. Contribución al conocimiento del ictioplancton de la laguna de Alvarado, Veracruz. Anales del Instituto de Ciencias del Mar y Limnología, 9: 141-160.
Franco-López, J. 2017. Análisis del comportamiento estacional e interanual de la comunidad ictiofaunística asociada a zonas de manglar en la laguna de Alvarado, Veracruz. Biología, Ciencia y Tecnología, 10: 722-735. https://doi.org/10.22201/fesi.20072082.2017.10.61475
Gómez, L. L., M. A. Sosa, C. I. Moreno y C. A. Jover. 2009. Biodiversidad, morfometría y alimentación de los cangrejos del género Callinectes (Decapoda: Portunidae) en Santiago de Cuba. Revista de Biología Tropical, 57: 671-686. https://doi.org/10.15517/rbt.v57i3.5483
Guillory, V., H. Perry, P. Steele, T. Wagner, W. Keithly, B. Pellegrin, J. Petterson, T. Floyd, B. Buckson, L. Hartman, E. Holder y C. Moss. 2001. The blue crab fishery of the Gulf of Mexico, United States: A regional management plan. Gulf States Marine Fisheries Commission, Ocean Springs, Mississippi. Vol 96.
Haye, P. A. y F. P. Ojeda. 1998. Metabolic and behavioral alterations in the crab Hemigrapsus crenulatus (Milne-Edwards 1837) induced by its acanthocephalan parasite Profilicollis antarcticus (Zdzitowiecki 1985). Journal of Experimental Marine Biology and Ecology,
228: 73-82. https://doi.org/10.1016/S0022-0981(98)00007-0
Hochberg, R. J., T. M. Bert, P. Steele y S. D. Brown. 1992. Parasitization of Loxothylacus texanus on Callinectes sapidus: aspects of population biology and effects on host morphology. Bulletin of Marine Science, 50: 117-132.
Høeg, J. T. 1995. The biology and life cycle of the Rhizocephala (Cirripedia). Journal of the Marine Biological Association of the United Kingdom, 75: 517-550. https://doi.org/10.1017/S0025315400038996
Høeg, J. T. y J. Lützen. 1995. Life cycle and reproduction in the Cirripedia Rhizocephala. Oceanography and Marine Biology-an Annual Review, 33: 427-485.
Lázaro-Chávez, E., F. Álvarez y C. Rosas. 1996. Records of Loxothylacus texanus (Cirripedia: Rhizocephala) parasitizing the blue crab Callinectes sapidus in Tamiahua lagoon, Mexico. Journal of Crustacean Biology, 16: 105-110. https://doi.org/10.1163/193724096X00324
López-Martínez, J., L. López-Herrera, J. E. Valdez-Holguín y C. H. Rábago-Quiroz. 2014. Population dynamics of the swimming crabs Callinectes (Portunidae) components of shrimp bycatch in the eastern coast of the Gulf of California. Revista de Biología Marina y Oceanografía, 49: 17-29. https://doi.org/10.4067/S0718-19572014000100003
Lorán, R. M., A. J. Valdez y F. Escudero. 1993. Algunos aspectos poblacionales de las jaibas Callinectes spp. en lagunas de Alvarado, Veracruz. Ciencia Pesquera, 10: 15-32.
Noever, C., J. Keiler y H. Glenner. 2016. First 3D reconstruction of the rhizocephalan root system using MicroCT. Journal of Sea Research, 113: 58-64. https://doi.org/10.1016/j.seares.2015.08.002
Norse, E. A. 1972. Preliminary study of six Jamaican blue crabs, genus Callinectes (Decapoda: Portunidae). Atoll Research Bulletin, 152: 5.
Norse, E. A. 1977. Aspects of the zoogeo graphic distribution of Callinectes (Brachyura: Portunidae). Bulletin of Marine Science, 27: 440-447.
Norse, E. A. 1978. An experimental gradient analysis: Hyposalinity as an ‘upstress’ distributional determinant for Caribbean portunid crabs. The Biological Bulletin, 155: 586-598.
O’Brien J. y P. Van Wyk. 1985. Effects of crustacean parasitic castrators (epicaridean isopods and rhizocephalan barnacles) on growth of crustacean hosts. In: Wenner, A. M. (Ed.). Factors in adult growth. A.A. Balkema, Rotterdam-Boston, 191-218 pp.
Park, J. 1969. A preliminary study of the blue crabs in Biscayne Bay. Quarterly Journal of the Florida Academy of Sciences, 32: 12-20.
Pearse, A. S. 1952. Parasitic crustaceans from alligator Harbor, Florida. The Quarterly Journal of the Florida Academy of Sciences, 15: 188-243.
Raz-Guzmán, A., G. de la Lanza y L. A. Soto. 1992. Caracterización ambiental y δ2 C del sedimento, detrito y vegetación del sistema lagunar de Alvarado, Veracruz, México. Revista de Biología Tropical, 40: 215-225.
Reinhard, E. G. 1950. An analysis of the effects of a sacculinid parasite on the external morphology of Callinectes sapidus Rathbun. Biological Bulletin, 98: 277-288. https://doi.org/10.2307/1538676
Reinhard, E. G. 1956. Parasitic castration of Crustacea. Experimental Parasitology, 5: 79-107. https://doi.org/10.1016/0014-4894(56)90007-8
Robles, R., F. Álvarez y G. Alcaraz. 2002. Oxygen consumption of the crab Callinectes rathbunae parasitized by the rhizocephalan barnacle Loxothylacus texanus as a function of salinity. Marine Ecology Progress Series, 235: 189-194. https://doi.org/10.3354/meps235189
Vázquez-López, H. 2010. Affectation of swimming capacity in Callinectes rathbunae] (Crustacea: Brachyura) caused by Loxothylacus texanus (Crustacea: Rhizocephala). Research Journal of Fisheries and Hydrobiology, 5: 76-80.
Vázquez-López, H. y F. Álvarez. 2007. Space temporal presence of the cirripede parasite Loxothylacus texanus in the lagoon-estuarine subsystem of Alvarado, Veracruz, México. International Journal of Zoological Research, 3: 157-168. https://doi.org/10.3923/ijzr.2007.157.168
Vázquez-López, H. y F. Álvarez. 2008. Efectos del rizocéfalo Loxothylacus texanus Boschma 1933, sobre Callinectes rathbunae Contreras 1930. BIOCYT Biología, Ciencia y Tecnología, 1: 1-6. https://doi.org/10.22201/fesi.20072082.2008.1.16841
Vázquez-López, H., F. Álvarez, J. Franco, A. Morán y S. Cházaro. 2006. Observations on the behavior of the dark crab Callinectes rathbunae Contreras parasitized with the rhizocephalan Loxothylacus texanus Boschma. International Journal of Zoological Research, 2: 344-353. https://doi.org/10.3923/ijzr.2006.344.353
Vázquez-López, H., F. Álvarez y S. Cházaro-Olvera. 2009. Externa emergence of Loxothylacus texanus Boschma, 1933 (Cirripedia, Rhizocephala) on the crab, Callinectes rathbunae Contreras, 1930 under laboratory conditions. Crustaceana, 82: 555-563 https://doi.org/10.1163/156854009X404725
Vázquez-López, H., R. Escamilla-Montes, G. Diarte-Plata, S. Cházaro-Olvera, A. C. Rodríguez-Varela, J. Franco-López, R. Chávez-López y A. Morán-Silva. 2020. Effects of the parasite Loxothylacus texanus on the agonistic behavior of the crab Callinectes rathbunae. International Journal of Zoological Studies, 6: 122-134. https://doi.org/10.33745/ijzi.2020.v06i01.010
Vivarès, C. P. y J. L. Cuq. 1981. Physiological and metabolic variations in Carcinus mediterraneus (Crustacea: Decapoda) parasitized by Thelohania maenadis (Microspora: Microsporida): an ecophysiopathological approach. Journal of Invertebrate Pathology, 37: 38-46. https://doi.org/10.1016/0022-2011(81)90052-5
Walker, G. 2001. Introduction to the Rhizocephala (Crustacea: Cirripedia). Journal of
Morphology, 249: 1-8. https://doi.org/10.1002/jmor.1038
Wardle, W. J. y A. J. Tirpak. 1991. Occurrence and distribution of an outbreak of infection of Loxothylacus texanus (Rhizocephala) in blue crabs in Galveston Bay, Texas, with special reference to size and coloration of the parasite’s external reproductive structures. Journal of Crustacean Biology, 11: 553-560. https://doi.org/10.2307/1548525
Williams, A. B. 1974. The swimming crabs of the genus Callinectes (Decapoda, Portunidae). Fishery Bulletin, 72: 685-798.
WoRMS. 2020. Callinectes Stimpson, 1860. [http://www.marinespecies.org/aphia.php?p=taxdetailsyid=106921]. Reviewed: september 09, 2020.
Yáñez-Arancibia, A. y Y. J. Day. 1988. Ecología de los ecosistemas costeros en el sur del Golfo de México: La región de la Laguna de Términos. Editorial Universitaria, UNAM-Organización de los Estados Americanos, México, 518 pp.
Zetlmeisl, C., J. Hermann, T. Petney, H. Glenner, C. Griffiths y H. Taraschewski. 2011. Parasites of the shore crab Carcinus maenas (L.): implications for reproductive potential and invasion success. Parasitology, 138: 394-401. https://doi.org/10.1017/S0031182010001344