INTRODUCCIÓN
En la actualidad, los arrecifes coralinos se encuentran muy degradados en muchas partes del mundo debido a eventos masivos de blanqueamiento, brotes de enfermedades, huracanes, la sobrepesca y la eutrofización (Schutte et al., 2010; Jackson et al., 2014; Duran et al., 2018). Esta vulnerabilidad puede ser aprovechada por las algas, las cuales compiten por el espacio con los corales, consiguen crecer sobre los corales vecinos o sus reclutas. Si estos procesos se extienden exitosamente en el tiempo, podría traer consigo un desfavorable cambio de fase, desde un ecosistema dominado por corales a uno dominado por algas (Mumby et al., 2014).
La actividad alimentaria de los organismos herbívoros marinos cumple numerosas funciones en el arrecife, entre ellas está el control de las algas, es la vía por la cual los consumidores primarios transforman la producción primaria, y finalmente, provee un sustrato para los nuevos reclutas de coral (Fox y Bellwood, 2007). Scaridae y Acanthuridae son dos familias de peces herbívoros cuya intensidad de pastoreo pudiera marcar la diferencia en un cambio de fase (Cheal et al., 2010). Incluso pueden consumir aquellas especies de algas que producen químicos alelopáticos muy tóxicos para los corales (Luna-Ortega y de la Cruz, 2017), pero no todos consumen los mismos tipos de algas, a la misma velocidad o de la misma manera. De ahí la importancia de considerar la diversidad funcional dentro del gremio (Edwards et al., 2014). De acuerdo a la morfología y a la conducta alimentaria, Scaridae se clasifica funcionalmente como raspadores/excavadores y Acanthuridae como picoteadores/detritívoros (Green y Bellwood, 2009). Sin embargo, el elevado cubrimiento algal no siempre implica mayor densidad de herbívoros. Cuando las algas, sobre todo foliosas, absorben gran cantidad de compuestos nitrogenados, no suelen ser agradables al gusto de los peces, por lo que la distribución e intensidad de pastoreo de estos peces puede estar condicionada por la calidad del alimento (Den Haan et al., 2013; Arias-González et al., 2017).
La problemática actual se extiende hacia la pérdida de estas especies, principalmente Scaridae, por la pesca indiscriminada, actividad que ha sido la fuente vital de ingresos y alimentos para miles de personas en las regiones costeras (Taylor et al., 2015; Mumby, 2016). La exclusión de los herbívoros por la explotación pesquera y el desarrollo costero progresivo conducen de manera rápida y constante al dominio de las macroalgas en muchos ecosistemas marinos y a su consecuente degradación (Burkepile y Hay, 2011; Östman et al., 2016; Arias-González et al., 2017).
Cuba no escapa a esta situación y un ejemplo de ello son los arrecifes de La Habana, cuya ictiofauna se compone en su mayoría de especies pequeñas y de nivel trófico bajo, además de una escasez de peces carnívoros, por lo que la presión pesquera se enfoca hacia especies de mediano tamaño como Scaridae y Acanthuridae (Aguilar, 2005; Duran y Claro, 2009; González-Sansón y Aguilar, 2010; García-Rodríguez et al., 2012; Duran et al., 2018). Debido a estas agravantes, en Cuba se adoptan medidas de conservación dirigidas a Acanthuridae y Scaridae, las cuales se exponen en la Resolución 160/2011 del CITMA, aunque en las zonas costeras de gran impacto antrópico es muy difícil controlar la pesca. Una herramienta que contribuye a la conservación de las comunidades de peces son las Áreas Marinas Protegidas (AMP), (Cobián-Rojas et al., 2011). El monitoreo sistemático de la ictiofauna dentro de las mismas, asegura evaluar la efectividad en el manejo y conservación de sus ecosistemas marinos. Lamentablemente, son pocos los estudios enfocados en los peces herbívoros del occidente cubano (Durán y Claro, 2009; Cabrera-Guerra et al., 2018; Delfín, 2018), además, carecemos de un conocimiento exhaustivo y necesario sobre la magnitud de las afectaciones que enfrentan los peces herbívoros en los arrecifes de Cuba y cómo estas condicionan su distribución y actividad alimentaria.
OBJETIVOS
- Estimar la densidad e intensidad de pastoreo de Scaridae y Acanthuridae y su relación con la cobertura de macroalgas, en dos localidades occidentales de Cuba con diferente nivel de protección.
MATERIALES Y MÉTODOS
Áreas de estudio. Se seleccionaron dos localidades del Occidente de Cuba: el Parque Nacional Guanahacabibes (PNG) con dos sitios de estudio y La Habana (LH) con un sitio (Fig. 1). La península de Guanahacabibes se encuentra ubicada en la parte más occidental del Municipio de Sandino, provincia Pinar del Río y se declara Reserva de la Biosfera para la UNESCO en 1987. Dada la elevada diversidad biológica y el buen estado de conservación, el Parque Nacional fue declarado legalmente el 14 de diciembre del 2001. La península es de conformación cársica y al no existir ríos, el escurrimiento terrígeno proviene de los manantiales subterráneos. En su vecindad no existen grandes asentamientos poblacionales que contribuyan a la contaminación o pesca excesiva. A excepción de la comunidad costera La Bajada que realiza actividades de pesca solo a cordel y anzuelo en un pequeño sector Bajada-Uvero Quemado, definido en la zonificación funcional del área protegida (Cobián-Rojas, 2016). El arrecife es de tipo costero cuyo perfil es el de una terraza única que culmina con un escarpe profundo de estructura variada con abundantes grietas y túneles irregulares a los cuales se asocia una amplia diversidad de peces (Cobián-Rojas et al., 2011). Los sitios de estudio: Laberinto y Yemayá se encuentran dentro de los límites del Parque Nacional y son estaciones de buceo recreativo administrados por el Centro Internacional de Buceo María la Gorda (Cobián-Rojas, 2016).
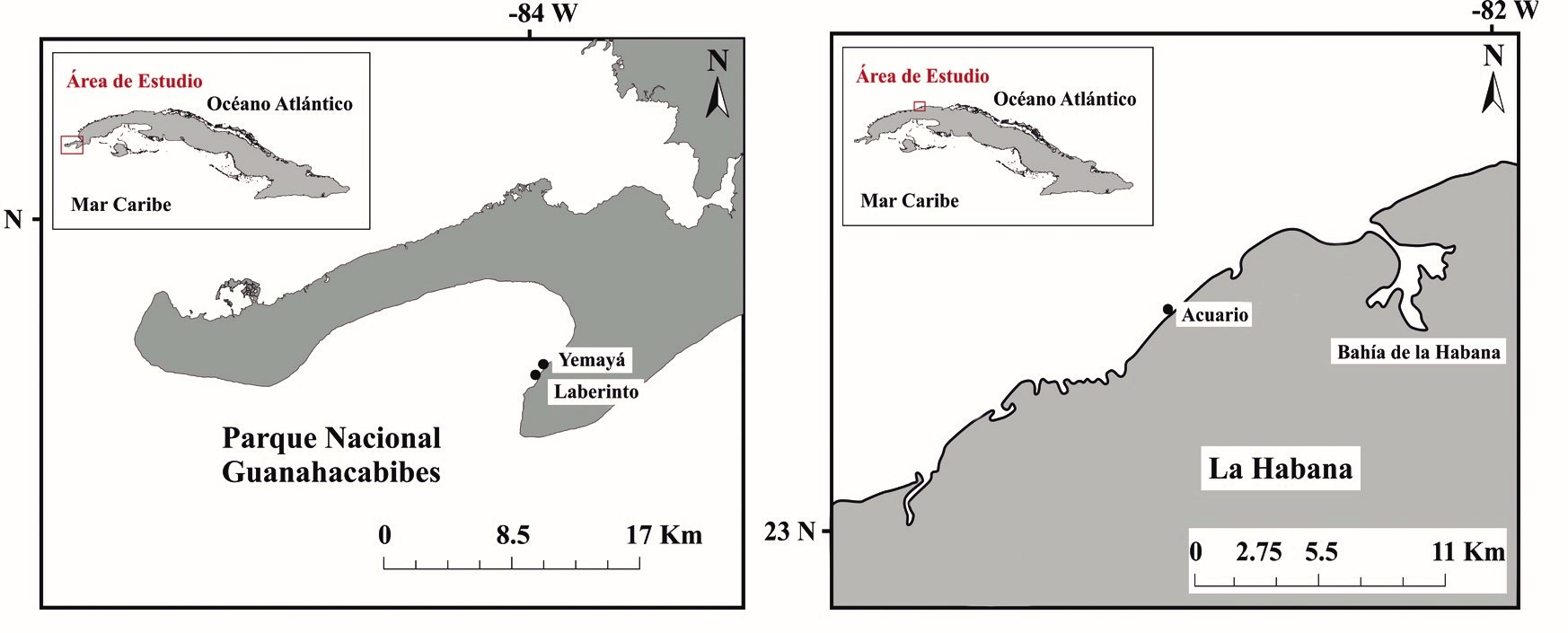
Figura 1. Ubicación de las localidades y sitios de estudio, en el occidente de Cuba. A, Parque Nacional Guanahacabibes; B, La Habana.
La otra localidad seleccionada fue La Habana (LH), la cual constituye la capital de Cuba, presenta un mayor desarrollo urbanístico y densidad poblacional que en el resto en las provincias. La ictiofauna de los arrecifes de coral a lo largo de la costa habanera está sometida a la contaminación y pesca excesiva por lo que el efecto más evidente es la casi total ausencia de especies de tamaño grande y mediano (González-Sansón y Aguilar, 2010; Duran et al., 2018), además de recibir la fuerte contaminación del río Almendares, lugar con elevada eutrofización y residuales industriales tóxicos (Olivares-Rieumont et al., 2005; Santana-Romero et al., 2012). El sitio de estudio en LH está frente a la costa del Acuario Nacional de Cuba. Aquí toda la franja costera hasta los siete metros de profundidad es una explanada rocosa con muy pocos refugios y no existen grandes porciones de fondos blandos (González-Sansón y Aguilar, 2010). Durante el invierno, la línea costera está sometida a un fuerte embate del oleaje que puede implicar penetraciones del mar y aumento del deterioro de las comunidades de coral (González-Sansón y Aguilar, 2010).
Metodología de muestreo y análisis de los datos. Entre septiembre del 2016 y abril del 2017, se muestreó el veril superior de cada sitio de estudio dos veces, una en el periodo lluvioso (mayo-octubre) y otro en el poco lluvioso (noviembre-abril). Se empleó la metodología descrita por Steneck (1983) pero usando video-cuadrantes. Esta consiste en fijar al fondo una cámara de alta definición GoPro HERO 3 usando una plomada y filmar, durante cinco minutos, todos los peces en un cuadrante de 1 m². El procedimiento se repitió hasta completar diez marcos al azar en cada muestreo. Los videos fueron analizados en la computadora, se contaron todos los individuos observados pertenecientes a las familias Acanthuridae y Scaridae y se clasificaron entre juveniles y adultos según el patrón de coloración descritos por Human y DeLoach (2014) y Froese y Pauly (2019). Además, se contó la cantidad de mordiscos que realizó cada individuo sobre el sustrato dentro del cuadrante, esto constituyó la intensidad de pastoreo y se da en Mordidas/5 minutos*m2. Se conoce la presencia de la especie Acanthurus bahianus, conviviendo con Acanthurus tractus, en el archipiélago cubano a partir de estudios genético-moleculares (Castellanos-Gell et al., 2012). Teniendo en cuenta que mediante los video-cuadrantes dichas especies no pueden diferenciarse se considerarán, en este documento, como un complejo Acanthurus bahianus/tractus.
Simultáneamente, se usó la metodología AGRRA (2001) para el muestreo de las macroalgas. Una cuerda de 10 m extendida al azar sobre la superficie del arrecife corresponde a un transecto y se coloca un cuadrante de 25x25 cm sobre el sustrato. En cada muestreo se realizaron seis transectos para obtener 30 cuadrantes en total. Para hallar la abundancia relativa de las algas erectas grandes, mayores de un cm (macroalgas frondosas), se anota el porciento de algas clasificadas hasta el taxón más bajo posible y se dividieron en los diferentes grupos morfo-funcionales (GMF) descritos por Littler y Littler (1984) y Steneck y Dethier (1994): foliosas, globosas, filamentosas, corticadas, coriáceas, calcáreas articuladas y costrosas.
A partir de la composición cuantitativa de todos los individuos de peces, se calculó el número de especies (S), el número total de individuos y la densidad media expresada como número de individuos/m2. En el análisis de la variación temporal y espacial, se aplicó la prueba no paramétrica de Kruskal-Wallis para detectar diferencias significativas y se realizó una comparación múltiple de media por rangos. Para declarar diferencias significativas, se tomó el nivel de significación p <0.05. Para medir la asociación entre la densidad e intensidad de pastoreo con la cobertura de las diferentes macroalgas, se utilizó la correlación no paramétrica de Spearman. Todos los análisis y gráficos se realizaron mediante los programas Statistica 8 y Excel de Office 2016.
RESULTADOS
Entre las dos localidades se hallaron 10 especies de peces herbívoros incluidos en las familias Acanthuridae y Scaridae, las cuales se muestran en la Tabla I. En el PNG se identificaron 446 individuos agrupados en ocho especies. De la familia Scaridae, se observaron tres especies del género Sparisoma y tres del género Scarus, donde Scarus iseri fue la más dominante y Scarus taeniopterus y Sparisoma chrysopterum fueron las más raras; por parte de Acanthuridae se observaron Acanthurus bahianus/tractus y Acanthurus coeruleus. En LH se identificaron 208 individuos agrupados en siete especies. De la familia Acanthuridae se observaron tres especies y A. bahianus/tractus fue la más abundante. Del género Scarus no se identificó ninguna especie y el género Sparisoma quedó mejor representado con cuatro especies, donde S. aurofrenatum fue la más abundante.
Tabla I. Abundancia y promedio de mordiscos de juveniles y adultos de Scaridae y Acanthuridae observados en el Parque Nacional Guanahacabibes y La Habana
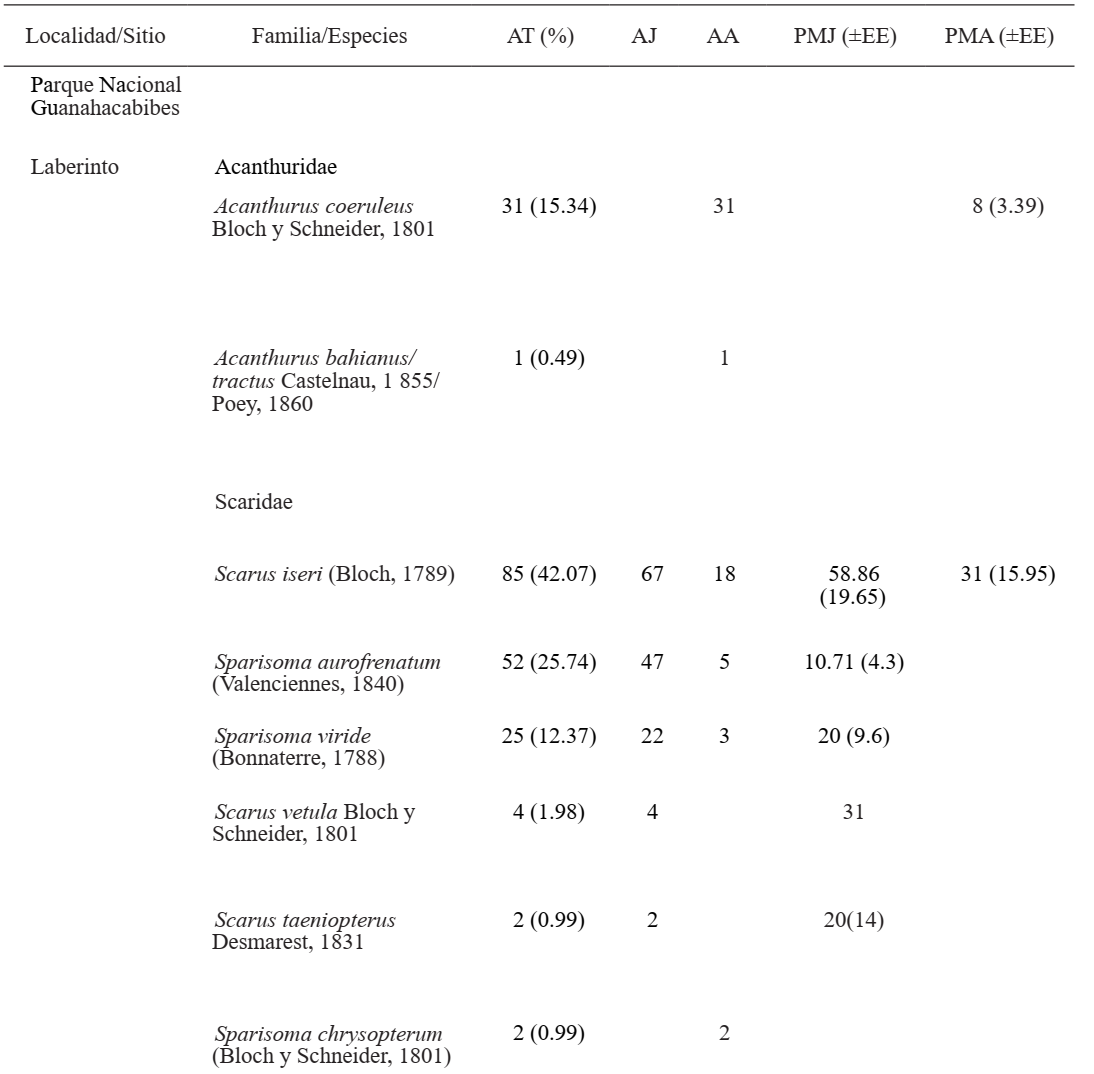
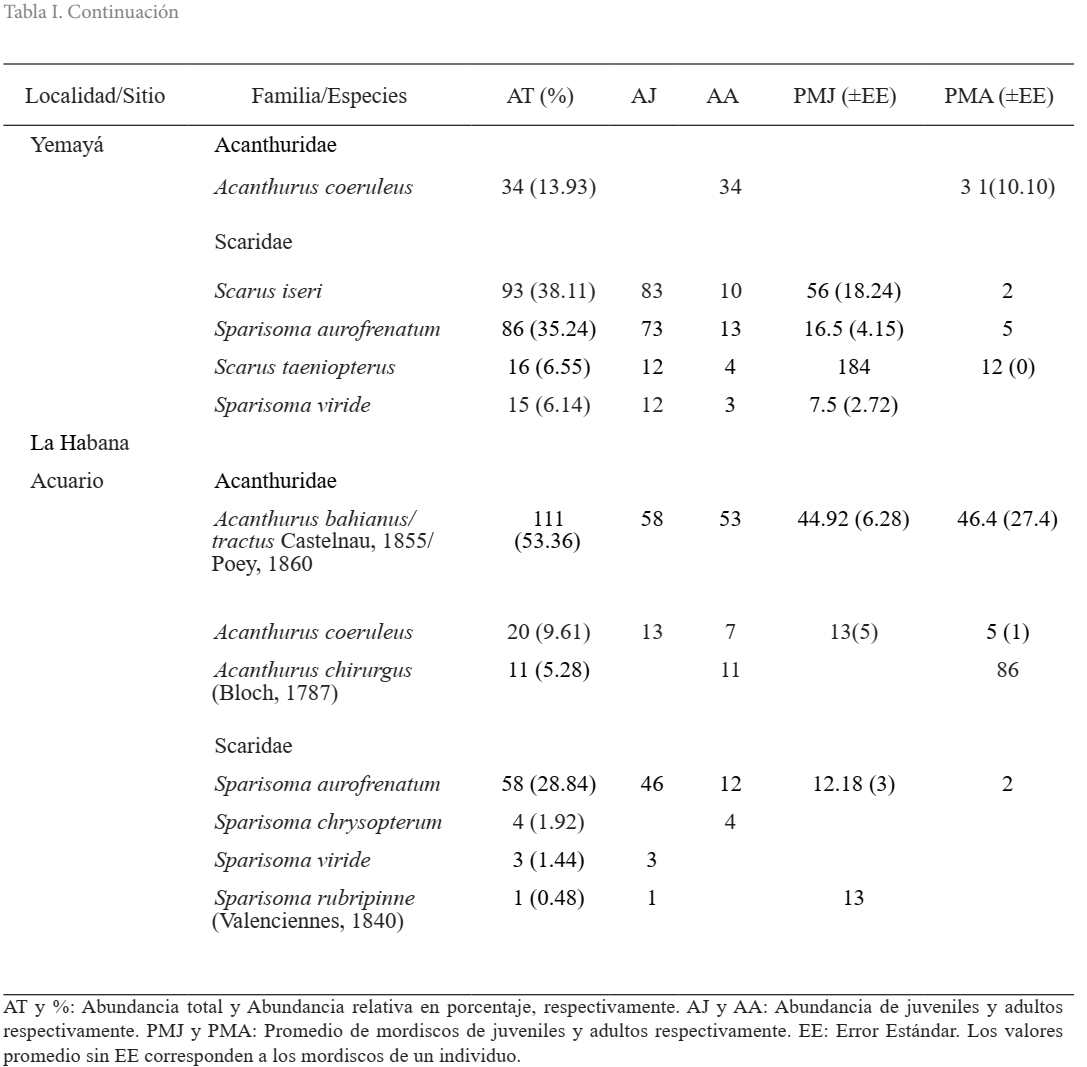
Sobre la intensidad de pastoreo, en el PNG, no se observaron diferencias significativas en Scaridae, pero en el periodo lluvioso hubo mayor actividad alimentaria. En cuanto a Acanthuridae, la intensidad de pastoreo de los adultos observados resultó con diferencias significativas y fue mayor en el periodo lluvioso. En LH, Scaridae mostró diferencias significativas y sólo se observó esta actividad en los juveniles, la cual fue mayor en el periodo lluvioso. En Acanthuridae no se observaron diferencias significativas y en ambos periodos estacionales, los juveniles mostraron mayor intensidad de pastoreo (Fig. 2).
En cuanto a la cobertura de macroalgas, se identificaron 13 géneros en total (cinco Chlorophyta, cuatro Rhodophyta y cuatro Phaeophyceae) agrupados en cinco GMF. En LH se observaron los 13 géneros identificados y en el PNG estuvieron presentes ocho de ellos (Tabla II).
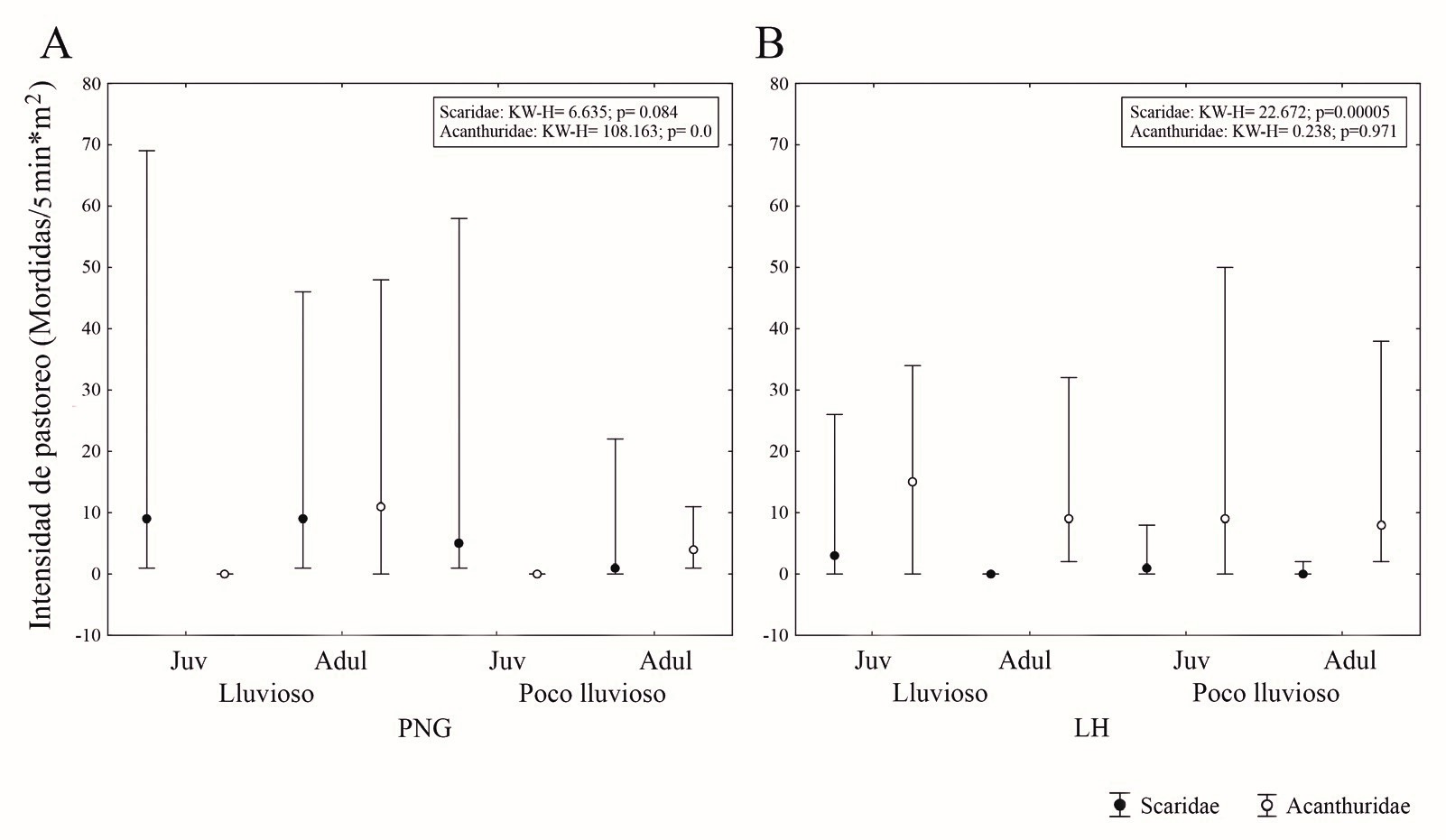
Figura 2. Intensidad de pastoreo (mordidas/5 minutos*m2) de juveniles y adultos de Scaridae y Acanthuridae en dos localidades occidentales de Cuba durante períodos lluvioso y poco lluvioso. Scaridae, círculos negros; Acanthuridae, cículos blancos; PNG, Parque Nacional Guanahacabibes; LH, La Habana (LH); KW-H, valor del test de Kruskal-Wallis.
Tabla II. Grupos morfo-funcionales y géneros de algas identificados en el Parque Nacional Guanahacabibes y La Habana.
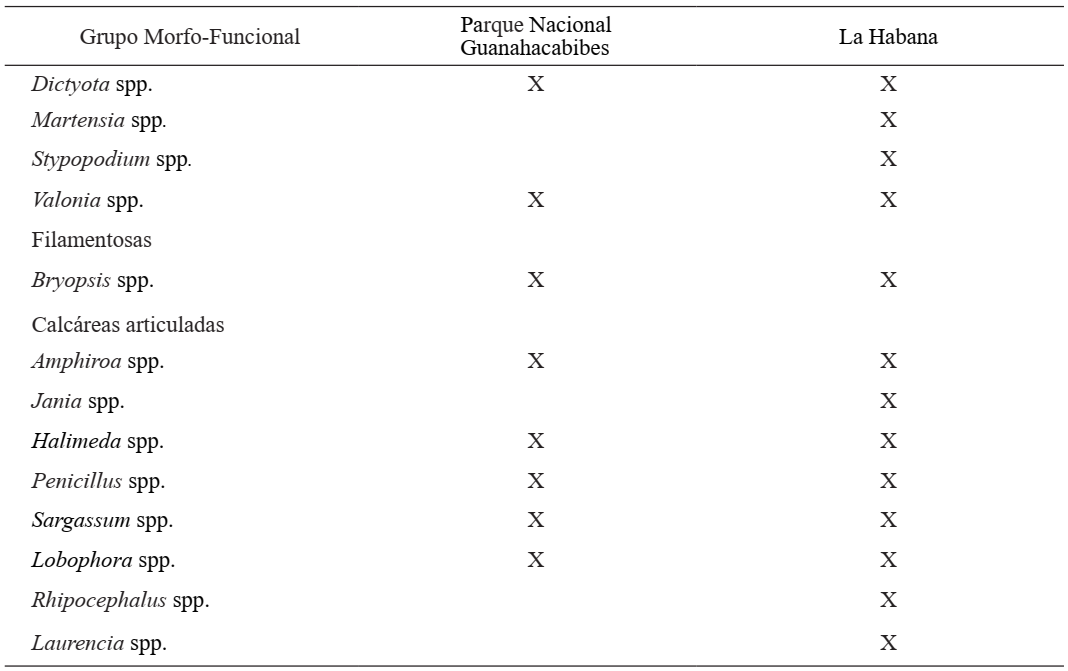
En el PNG ambos periodos estacionales mostraron mayor representación de algas foliosas y globosas (Fig. 3), donde Dictyota spp. fue el género que más se destacó. De los dos géneros observados de algas calcáreas articuladas, Halimeda spp. fue el más representativo y Lobophora spp. en las macrófitas coriáceas. En LH predominaron las algas macrófitas coriáceas en ambos periodos estacionales (Fig. 3), donde Sargassum spp. mostró mayor representación. De las calcáreas articuladas, Amphiroa spp. fue la más abundante y de las foliosas y globosas, se destacó Stypopodium spp. Además, LH fue la única localidad que mostró algas macrófitas corticadas, representadas sólo por el género Laurencia en el período poco lluvioso.
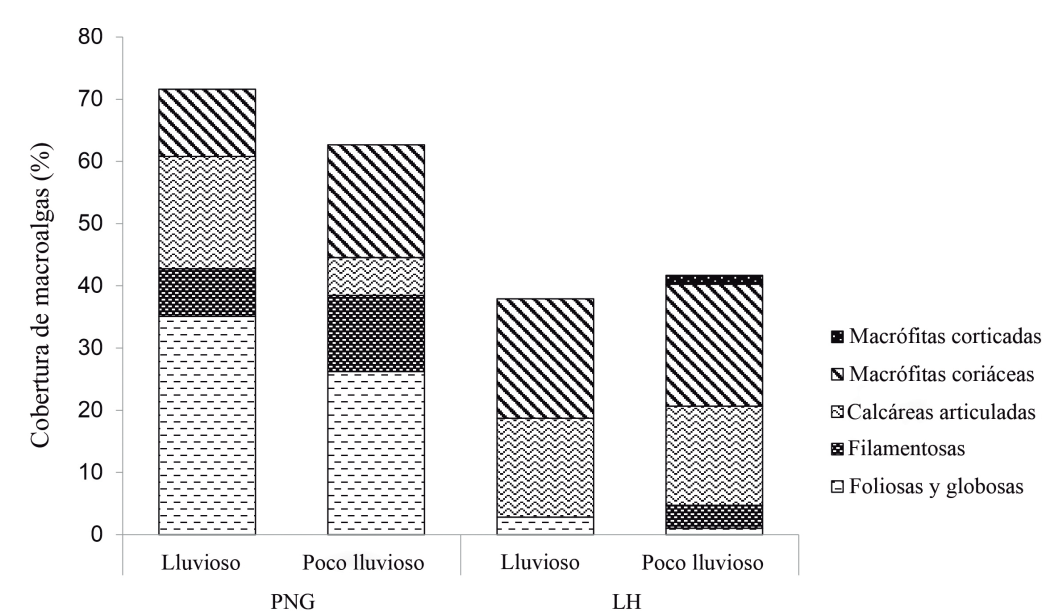
Figura 3. Cobertura (%) de los grupos morfo-funcionales de algas observados en dos localidades occidentales de Cuba durante períodos lluvioso y poco lluvioso. PNG, Parque Nacional Guanahacabibes; LH, La Habana.
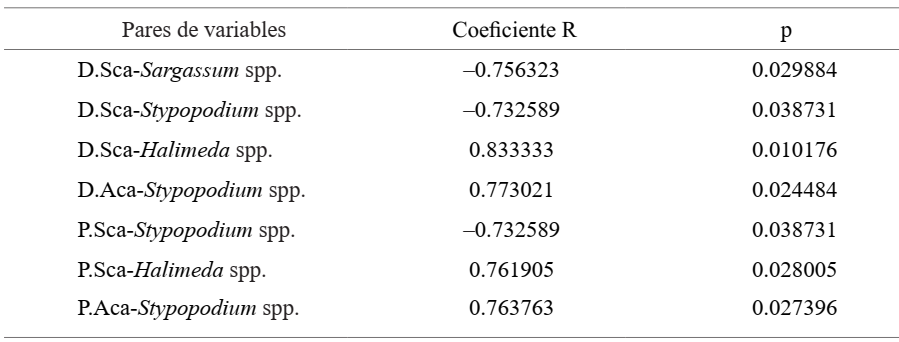
Se encontró alta y significativa correlación entre la densidad e intensidad de pastoreo de Scaridae y Acanthuridae con la cobertura de las algas (cuatro y tres géneros respectivamente), cuyos valores se muestran en la Tabla III. El género Halimeda mostró el mayor coeficiente R en las correlaciones con la densidad e intensidad de pastoreo de Scaridae, en ambos, la correlación dio positiva. La densidad e intensidad de pastoreo de Acanthuridae sólo mostró correlación significativa con la cobertura de Stypopodium spp., ambos coeficientes R fueron positivos.
Tabla III. Coeficientes de correlación R que resultaron significativos entre la densidad e intensidad de pastoreo de Scaridae y Acanthuridae con los diferentes géneros de macroalgas.
DISCUSIÓN
El total de especies observadas entre Scaridae y Acanthuridae, es inferior al de otras investigaciones en el resto del Caribe (Toller et al., 2010; Kopp et al., 2012; Hernández-Landa et al., 2014) y dentro de los mismos sitios de estudio (Cabrera-Guerra et al., 2018) y representa sólo el 58 % del total reportado para Cuba (Human y DeLoach, 2014; Froese y Pauly, 2019). Es probable que el método empleado (Steneck, 1983) y su derivado en video-transectos, no haya sido el adecuado para estimar densidad con pocos muestreos. Este método abarca un área muy reducida, lo cual pudiera ser una desventaja para calcular densidad, dada la movilidad de los peces. Sin embargo, se ha comprobado la factibilidad del mismo para el estudio de la actividad alimentaria en peces herbívoros (Steneck, 1983; Duran y Claro, 2009; Vergés et al., 2016).
Históricamente el PNG ha mostrado todas las especies de Scaridae y Acanthuridae reportadas para Cuba (Claro y Cantelar, 2003; Cobián-Rojas et al., 2011; Cobián-Rojas, 2016) y estudios recientes muestran el buen estado de sus poblaciones, las cuales incluyen especies con tallas superiores a los 30 cm de largo total (Cabrera-Guerra et al., 2018). En LH, las especies de Acanthuridae suelen ser las más abundantes y de Scaridae predominan las del género Sparisoma (Cabrera-Guerra et al., 2018) lo cual se refleja en este estudio, salvo la ausencia de especies del género Scarus en los video-cuadrantes. Hasta el momento no se ha afectado el reclutamiento de Scaridae en LH dada la abundancia de juveniles, a pesar de la escasez de individuos adultos (Duran y Claro, 2009; Cabrera-Guerra et al., 2018). Este proceso pudiera estar favorecido por la importación de larvas desde sitios mejor conservados (Hawkins y Roberts, 2003).
La herbivoría es más intensa en los trópicos (Vergés et al., 2016), en Cuba el ambiente cálido se extiende durante casi todo el año y destacan dos periodos estacionales marcados por las lluvias. El enriquecimiento de las aguas provocado por las precipitaciones, generalmente favorece los picos de biomasa en las algas (Ávila-Alonso et al., 2013). Es por esto que la mayor intensidad de pastoreo se observó en el periodo lluvioso para ambas localidades. Por otro lado, esta actividad alimentaria destacó en los juveniles de Scaridae tanto en el PNG como en LH. Gracias al metabolismo rápido de estos ejemplares, la estrategia evolutiva contra los depredadores es el crecimiento rápido (Claro y García-Arteaga, 2001), de ahí la necesidad de consumir la mayor cantidad de alimento posible en menos tiempo. En cambio, los adultos presentan una boca más grande, por lo que con pocas mordidas son capaces de incorporar mayor materia orgánica. Esta misma estrategia fue observada en Acanthuridae, aunque solo en LH.
La mayor proporción de Acanthuridae respecto a Scaridae que figura en muchos sitios de LH, ya es una tendencia invariable desde hace más de 10 años a causa de la sobrepesca (Aguilar, 2005; Duran y Claro, 2009; García-Rodríguez et al., 2012; Cabrera-Guerra et al., 2018; Duran et al., 2018). Esta pérdida excesiva de Scaridae de media y gran talla en sitios más antropizados, implica que Acanthuridae representa un exceso de un grupo funcional que no se especializa en eliminar grandes parches de macroalgas (Francini-Filho et al., 2010; Marshell y Mumby, 2015). El sustrato desnudo que provee la intensidad de pastoreo de Scaridae, es vital para el reclutamiento de corales y algas coralinas costrosas (Mumby et al., 2014; Mumby, 2016).
Las algas foliosas y globosas fueron las que más predominaron en el PNG en ambos periodos estacionales, sin embargo, no se encontró correlación significativa. Este escenario parece ser un factor recurrente en la zona (Perera-Valderrama et al., 2016, 2017), lo cual puede estar condicionado por la presencia de un sistema de lagunas costeras interconectadas con el área marina. Estas lagunas costeras terrestres normalmente aportan nutrientes a través del flujo debajo de la duna, que depende de la dinámica de las mareas y el nivel del mar y se favorece por la estructura kárstica permeable característica del PNG (Iturralde-Vinent, 2010).
Además, la baja diversidad de macroalgas observada en el PNG comparado con LH, sugiere el buen estado de conservación y la escasa contaminación del área protegida.
La densidad e intensidad de pastoreo de Scaridae tuvo una correlación positiva con Halimeda spp. Tanto Scaridae como Halimeda spp. estuvieron mejor representados en el PNG y este resultado pudiera tener dos significados. En primer lugar, las características morfológicas y los compuestos químicos secundarios de Halimeda spp. parecen reducir la herbivoría. Lewis (1985) observó cierta susceptibilidad de Scaridae ante Halimeda spp. aunque la correlación de la herbivoría con las características de estas algas, no ha sido muy clara. Además, en los trópicos los peces herbívoros han aumentado su resistencia a las defensas químicas de algunas macroalgas, por lo que cuando aumenta la cobertura de las mismas, también hay mayor densidad e intensidad de pastoreo de los herbívoros (Cronin et al., 1997; Vergés et al., 2016). Por otro lado, Ferreira y Gonçalves (2006) y Castro-Sanguino et al. (2016), refieren que las especies del género Halimeda son muy consumidas por la familia Scaridae. La incorporación de entidades alimentarias con abundante carbonato de calcio es muy común en la familia Scaridae, incluso raspan la superficie de corales como Porites spp. y Orbicella spp. (Burkepile, 2012; Welsh et al., 2015).
Las algas Sargassum spp. y Stypopodium spp. mostraron mayor cobertura en LH y una correlación negativa con la familia Scaridae. Aunque es de esperar por la baja densidad e intensidad de pastoreo de Scaridae, estos peces consumen en menor medida algas foliosas como Stypopodium spp. Muchas especies de algas foliosas pueden absorber altas tasas de compuestos tóxicos derivados del amonio y fosfato, y a mayor velocidad que otros organismos del arrecife (Den Haan et al., 2013). Las grandes concentraciones de estas sustancias disueltas en el mar están asociadas a fuentes contaminantes que llegan por escorrentía y vertimientos (Mumby et al., 2014), de ahí que la alta densidad de muchas especies de algas son bioindicadoras de eutrofización (Östman et al., 2016), sobre todo en sitios tan contaminados como los de LH. Respecto a Sargassum spp., varias especies de este género figuran entre las entidades alimentarias de los peces herbívoros en general (Lewis, 1985; Ferreira y Gonçalves, 2006; Hoey y Bellwood, 2010), pero es poco probable que el pastoreo de los juveniles pueda desprender el talo fuerte de las mismas. La cobertura de Sargassum spp. suele ser muy exitosa ante el herbivorismo gracias a su estructura morfológica con cauloides espinosos y filoides con bordes duros y dentados (Hoey y Bellwood, 2010; Loffler et al., 2018), más bien las algas epifitas que crecen sobre esta especie, son el objetivo principal de algunos herbívoros (Ferreira y Gonçalves, 2006).
La familia Acanthuridae sólo mostró correlación significativa con Stypopodium spp. y el hecho de ser positiva pudiera indicar la elevada densidad que muestran estos grupos en LH. Sobre Stypopodium spp. crecen muchas algas epífitas como Ceramium spp., Gelidium spp. y Amphiroa spp. (Suárez et al., 2014), que constituyen entidades alimentarias de Acanthuridae, sobre todo las filamentosas (Ferreira y Gonçalves, 2006; Abitia-Cárdenas et al., 2011). Este grupo funcional de herbívoros tiende a tener las tasas de pastoreo más altas (Duran y Claro, 2009; Francini-Filho et al., 2010) y probablemente son los principales contribuyentes al cultivo de algas cespitosas (Marshell y Mumby, 2015), las cuales, a menudo, son el primer grupo bentónico en aumentar su densidad luego de la mortalidad de los corales (Vermeij et al., 2010). De ahí la reiterada importancia de presentar comunidades más equitativas con diferentes grupos funcionales de peces herbívoros que contribuyan a un control más efectivo de las macroalgas.
CONCLUSIONES Y RECOMENDACIONES
La riqueza de especies fue similar en ambas localidades, pero es necesario emplear simultáneamente métodos de muestreo de densidad y actividad alimentaria, además de aumentar el número de muestreos, lo cual podría brindar mejores estimados. Aunque la intensidad de pastoreo se favorece con la mayor diversidad y cobertura algal que muestra el periodo lluvioso, el nivel de contaminación y sobrepesca que existe en LH no beneficia la comunidad de Scaridae y su consecuente rol de control biológico. La limpieza que presentan las aguas del PNG, pudiera favorecer la calidad de las algas como alimento, aunque haya menos diversidad. Un estudio más prolongado en el tiempo en localidades protegidas y mejor conservadas como el PNG, puede enriquecer la información sobre la intensidad de pastoreo y la preferencia alimentaria de los peces herbívoros. Al parecer, Acanthuridae no se ve seriamente perjudicada por el impacto antrópico, más bien son los herbívoros dominantes en LH y esto representa un exceso de un grupo funcional de peces cuya actividad alimentaria no provee un sustrato desnudo para el exitoso reclutamiento del bentos.
AGRADECIMIENTOS
Por la elaboración del conjunto de actividades que hicieron posible este trabajo, los autores agradecen a los colaboradores del Parque Nacional Guanahacabibes, a todos los trabajadores del Centro Internacional de Buceo María la Gorda, a la MC. Juliett González Méndez del Centro Nacional de Áreas Protegidas de Cuba y al Dr. Hansel Caballero Aragón de la Comisión Nacional para el Conocimiento y uso de la Biodiversidad de México.
Literatura Citada
Abitia-Cárdenas, L., X. Moreno-Sánchez, D. Palacio-Salgado y O. Escobar-Sánchez. 2011. Feeding habits of the convict surgeonfish Acanthurus triostegus (Teleostei: Acanthuridae) on the Los Frailes reef, Baja California Sur, Mexico. Aqua International Journal of Ichthyology, 17 (3): 103-108.
Atlantic and Gulf Rapid Reef Assessment (AGRRA). 2001. The AGRRA Rapid Assessment Protocol. Atlantic and gulf Rapid Reef Assessment methodology. http://coral.aoml.noaa.gov/agra/methodhome.htm (accesado: junio 25, 2001).
Aguilar, C. 2005. Ictiofauna costera de Ciudad de la Habana, efectos acumulativos de agentes estresantes múltiples en varios niveles de organización biológica. Tesis en opción al grado científico de Doctora en Ciencias Biológicas, 122 pp.
Arias-González, J. E., T. Fung, R. Seymour, J. Garza-Pérez, G. Acosta-González, Y. Bozec y C. Jhonson. 2017. A coral-algal phase shift in Mesoamerica not driven by changes in herbivorous fish abundance. PLoS ONE, 12 (4). https://doi.org/10.1371/journal.pone.0174855
Ávila-Alonso, D., M. Guimaraes y R. Cárdenas. 2013. Variación espacio-temporal de grupos morfo-funcionales de macroalgas en pastos marinos al norte de Ciego de Ávila, Cuba. Revista de Investigaciones Marinas, 33 (1): 14-22. ISSN: 1991-6089.
Burkepile, D. E. 2012. Context-dependent corallivory by parrotfishes in a Caribbean reef ecosystem. Coral Reefs, 31 (1): 111-120. https://doi.org/10.1007/s00338-011-0824-5
Burkepile, D. E. y M. E. Hay. 2011. Feeding complementarity versus redundancy among herbivorous fishes on a Caribbean reef. Coral Reefs, 30 (2): 351-362. https://doi.org/10.1007/s00338-011-0726-6
Cabrera-Guerra, D., P. Chevalier-Monteagudo, D. Cobián, R. Corrada, R. Fernández, H. Caballero y K. Campos. 2018. Variación espacio-temporal de los peces herbívoros (Acanthuridae y Scaridae) en dos localidades arrecifales de Cuba con diferentes niveles de conservación. Revista de Investigaciones Marinas, 38: 67-82. ISSN:1991-6086 RNPS:2096
Castellanos-Gell, J., A. Robainas-Barcia, D. Casane, P. Chevalier-Monteagudo, F. PinaAmargós y E. García-Machado. 2012. The surgeonfish, Acanthurus bahianus, has crossed the Amazon-Orinoco outflow barrier. Marine Biology, 159: 1561-1565. https://doi.org/10.1007/s00227-012-1942-5
Castro-Sanguino, C., C. Lovelock y P. J. Mumby. 2016. The effect of structurally complex corals and herbivory on the dynamics of Halimeda. Coral Reefs, 35: 597-606. https://doi.org/10.1007/s00338-016-1412-5
Cheal, A. J., M. A. MacNeil, E. Cripps, M. J. Emslie, M. Jonker, B. Schaffelke y H. Sweatman. 2010. Coral-macroalgal phase shifts or reef resilience: links with diversity and functional roles of herbivorous fishes on the Great Barrier Reef. Coral Reefs, 29 (4): 1005-1015.
Claro, R. y J. García-Arteaga. 2001. Growth patterns of fishes of the Cuban shelf, (pp. 149-178). En: Claro R., K. C. Lindeman y L. R. Parenti (Eds.). Ecology of the marine fishes of Cuba, Smithsonian Institution Press, Washington y Londres, 270 pp. https://doi.org/10.1007/s00338-010-0661-y
Claro, R. y K. Cantelar Ramos. 2003. Rapid assessment of coral communities of María la Gorda, southeast Ensenada de Corrientes, Cuba (Part 2: Reef fishes). Atoll Research Bulletin, 496 (16): 278-293. https://doi.org/10.5479/si.00775630.496-16.278
Cobián-Rojas, D. 2016. Impacto potencial del pez león sobre la comunidad de peces en dos áreas marinas protegidas del Caribe (Cuba y México). Tesis presentada como requisito parcial para optar al grado de Doctorado en Ciencias en Ecología y desarrollo sustentable con orientación en conservación de la biodiversidad, 126 pp.
Cobián-Rojas, D., R. Claro, P. Chevalier-Monteagudo, S. Perera y H. Caballero. 2011. Estructura de las asociaciones de peces en los arrecifes coralinos del Parque Nacional Guanahacabibes, Cuba. Revista Marina y Costera, 3: 153-169. https://doi.org/10.15359/revmar.1.6
Cronin, G., V. J. Paul, M. E. Hay y W. Fenical. 1997. Are tropical herbivores more resistant than temperate herbivores to seaweed chemical defenses? Diterpenoid metobolites from Dictyota acutiloba as feeding deterrents for tropical versus temperate fishes and urchins. Journal of Chemical Ecology, 23 (2): 289-302. https://doi.org/10.1023/B:JOEC.0000006360.36833.13
Delfín, S. 2018. Diversidad de organismos herbívoros en dos crestas arrecifales de la región noroccidental de Cuba. Tesis presentada en opción al título de Licenciado en Biología, Universidad de la Habana, Cuba, 106 pp.
Den Haan, J., J. Huisman, F. Dekker, J. ten Brinke, A. K. Ford, J. van Ooijen, F. van Duyl, M. Vermeij y P. M. Visser. 2013. Fast detection of nutrient limitation in macroalgae and seagrass with nutrient-induced fuorescence. PLoS ONE, 8 (7). https://doi.org/10.1371/journal.pone.0068834
Duran, A. y R. Claro. 2009. Actividad alimentaria de los peces herbívoros y su impacto en arrecifes con diferente nivel de degradación antrópica. Revista de Biología Tropical, 57 (3): 687-697.
Duran, A., A. A. Shantz, D. E. Burkepile, L. Collado-Vides, V. M. Ferrer, L. Palma, A. Ramos y P. González-Díaz. 2018. Fishing, pollution, climate change, and the long- term decline of coral reefs off Havana, Cuba. Bulletin of Marine Science, 94 (2): 213-228. https://doi.org/10.5343/bms.2017.1061
Edwards, C. B., A. M. Friedlander, A. G. Green, M. J. Hardt, E. Sala, H. P. Sweatman, I. Williams, B. Zgliczynski, A. Sandin y J. E. Smith. 2014. Global assessment of the status of coral reef herbivorous fishes: evidence for fishing effects. Proceedings of the Royal Society B: Biological Sciences, 281(1774). https://doi.org/10.1098/rspb.2013.1835
Ferreira, C. E. y J. E. A. Gonçalves. 2006. Community structure and diet of roving herbivorous reef fishes in the Abrolhos Archipelago, south‐western Atlantic. Journal of Fish Biology, 69 (5): 1533-1551. https://doi.org/10.1111/j.1095-8649.2006.01220.x
Fox, R. J. y D. R. Bellwood. 2007. Quantifying herbivory across a coral reef depth gradient. Marine Ecology Progress Series, 339: 49-59.
Francini-Filho, R. B., C. M. Ferreira, E. O. C. Coni, R. L. De Moura y L. Kaufman. 2010. Foraging activity of roving herbivorous reef fish (Acanthuridae and Scaridae) in eastern Brazil: influence of resource availability and interference competition. Journal of the Marine Biological Association UK, 90 (3): 481-492. https://doi.org/10.1017/S0025315409991147
Froese, R. y D. Pauly. 2019. FishBase. World Wide Web electronic publication. www.fishbase.org, version 06/2017.
García-Rodríguez, A., A. L. Lorenzo y N. G. Rodríguez. 2012. Evaluación de las asociaciones de peces arrecifales en el oeste del litoral de La Habana, zona noroccidental de Cuba. Serie Oceanológica, 11: 77-90.
González-Sansón, G. y C. Aguilar. 2010. Reef fish diversity components as indicators of cumulative effects in a highly impacted fringe reef. Ecological Indicators, 10: 766-772. https://doi.org/10.1016/j.ecolind.2009.11.009
Green, A. L. y D. R. Bellwood. 2009. Monitoring functional groups of herbivorous reef fishes as indicators of coral reef resilience - A practical guide for coral reef managers in the Asia Pacific region. IUCN working group on Climate Change and Coral Reefs. IUCN, Gland, Switzerland, 70 pp.
Hawkins, J. P. y C. M. Roberts. 2003. Effects of fishing on sex-changing Caribbean parrotfishes. Biological Conservation, 115: 213-226. https://doi.org/10.1016/S0006-3207(03)00119-8
Hernández‐Landa, R. C., G. Acosta‐González, E. Núñez‐Lara y J. E. Arias‐González. 2014. Spatial distribution of surgeonfish and parrotfish in the north sector of the Mesoamerican Barrier Reef System. Marine Ecology, 36 (3): 432-446. https://doi.org/10.1111/maec.12152
Hoey, A. S. y D. R. Bellwood. 2010. Among-habitat variation in herbivory on Sargassum spp. on a mid-shelf reef in the northern Great Barrier. Reef. Marine Biology, 157 (1): 189-200. https://doi.org/10.1007/s00227-009-1309-8
Human, P. y N. DeLoach. 2014. Reef fish identification. Florida, Caribbean, Bahamas. (4th, Ed): New World Publications, Inc, Florida, Estados Unidos, 537 pp.
Iturralde-Vinent, M. 2010. Geología de Cuba para todos. Editorial Científico-Técnica, La Habana, Cuba, 150 pp.
Jackson, J., M. Donovan, K. Cramer y V. Lam. (Eds). 2014. Status and Trends of Caribbean Coral Reefs: 1970-2012. Global Coral Reef Monitoring Network. IUCN, Gland, Switzerland, 304 pp.
Kopp, D., Y. Bouchon-Navaro, M. Louis, P. Legendre y C. Bouchon. 2012. Spatial and Temporal Variation in a Caribbean Herbivorous Fish Assemblage. Journal of Coastal Research, 28 (1A): 63-72. https://doi.org/10.2112/JCOASTRES-D-09-00165.1
Lewis, S. M. 1985. Herbivory on coral reefs: algal susceptibility to herbivorous fishes. Oecologia, 65 (3): 370-375. https://doi.org/10.1007/BF00378911
Littler, M. M. y D. S. Littler. 1984. Relationships between macoalgal functional form groups and substrata stability in a subtropical rocky-intertidal system. Journal of Experimental Marine Biology and Ecology, 74 (1): 13-34. https://doi.org/10.1016/0022-0981(84)90035-2
Loffler, Z., A. Graba-Landry, J. T. Kidgell, E. McClure, M. S. Pratchett y A. S. Hoey. 2018. Holdfasts of Sargassum swartzii are resistant to herbivory and resilient to damage. Coral Reefs, 37 (4): 1075-1084. https://doi.org/10.1007/s00338-018-01745-w
Luna-Ortega, I. y F. de la Cruz. 2017. Ensambles de macroalgas sobre superficies muertas de corales escleractíneos (Anthozoa: Scleractinea) en el arrecife Oro Verde, Veracruz, México. Oceánides, 32 (1): 11-23. http://dx.doi.org/10.37543/oceanides.v32i1.192
Marshell, A. y P. J. Mumby. 2015. The role of surgeonfish (Acanthuridae) in maintaining algal turf biomass on coral reefs. Journal of Experimental Marine Biology and Ecology, 473: 152-160. https://doi.org/10.1016/j.jembe.2015.09.002
Mumby, P. J. 2016. Stratifying herbivore fisheries by habitat to avoid ecosystem overfishing of coral reefs. Fish and Fisheries, 17 (1): 266-278. https://doi.org/10.1111/faf.12078
Mumby, P. J., J. Flower, I. Chollett, J. S. Box, Y. M. Bozec, C. Fitzsimmons, …y S. M. Williams. 2014. Hacia la resiliencia del arrecife y medios de vida sustentables: Un manual para los administradores de arrecifes de coral del Caribe. Exeter: University of Exeter, 172 pp.
Olivares-Rieumont, S., D. de la Lanza, L. Lima, D.W. Graham, K. D´Alessandro, J. Borroto, F. Martínez y J. Sánchez. 2005. Assessment of heavy metal levels in Almendares River sediments Havana City, Cuba. Water Research, 39: 3945-3953. https://doi.org/10.1016/j.watres.2005.07.011
Östman, Ö., J. Eklöf, B. K. Eriksson, J. Olsson, P. O. Moksnes y U. Bergström. 2016. Top‐down control as important as nutrient enrichment for eutrophication effects in North Atlantic coastal ecosystems. Journal of Applied Ecology, 53 (4): 1138-1147. https://doi.org/10.1111/1365-2664.12654
Perera-Valderrama, S., H. Hernández-Arana, M. Á. Ruiz-Zárate, P. M. Alcolado, H. CaballeroAragón, J. González-Cano, J. González-Cano y D. Cobián-Rojas. 2016. Condition assessment of coral reefs of two marine protected areas under different regimes of use in the north-western Caribbean. Ocean & Coastal Management, 127: 16-25. https://doi.org/10.1016/j.ocecoaman.2016.04.001
Perera-Valderrama, S., H. Hernández-Arana, M. Á. Ruiz-Zárate, P. M. Alcolado, H. CaballeroAragón, J. González-Cano, ... y E. de la Guardia-Llansó. 2017. Temporal dynamic of reef benthic communities in two marine protected areas in the Caribbean. Journal of Sea Research, 128: 15-24. https://doi.org/10.1016/j.seares.2017.07.007
Santana-Romero, J. L., M. Valdés-Callado, S. Olivares-Rieumont y L. Lima-Cazorla. 2012. Determinación de hidrocarburos aromáticos policíclicos ligeros en aguas superficiales de los ríos Almendares y Luyanó en La Habana. Revista CENIC. Ciencias Químicas, 43: 1-7.
Schutte, V. G., E. R. Selig y J. F. Bruno. 2010. Regional spatio-temporal trends in Caribbean coral reef benthic communities. Marine Ecology Progress Series, 402: 115-122. https://doi.org/10.3354/meps08438
Steneck, R. S. 1983. Quantifying herbivory on coral reefs: Just scratching the surface and still biting off more than we can chew. En L. Reaka (ed.): The ecology of deep and shallow coral reefs, Simposia Series for Undersea Reserarch. NOAA´SUndersea Research Program, 1 (1): 103-111.
Steneck, R. S. y M. N. Dethier. 1994. A functional group approach to the structure of algal-dominated communities. Oikos, 69: 476-498. https://doi.org/10.2307/3545860
Suárez, A. M., B. Martínez-Daranas y Y. Alfonso. 2014. Macroalgas marinas de Cuba. Universidad de la Habana, 262 pp.
Taylor, B. M., S. J. Lindfield y J. H. Choat. 2015. Hierarchical and scale-dependent effects of fishing pressure and environment on the structure and size distribution of parrotfish communities. Ecography, 38 (5): 520-530. https://doi.org/10.1111/ecog.01093
Toller, W., A. O. Debrot, M. J. Vermeij y P. C. Hoetjes. 2010. Reef fishes of Saba Bank, Netherlands Antilles: assemblage structure across a gradient of habitat types. PloS ONE, 5 (5). https://doi.org/10.1371/journal.pone.0009207
Vergés, A., C. Doropoulos, H. A. Malcolm, M. Skye, M. Garcia-Pizá, E. M. Marzinelli... y P. D. Steinberg. 2016. Long-term empirical evidence of ocean warming leading to tropicalization of fish communities, increased herbivory, and loss of kelp. Proceedings of the National Academy of Sciences, 113 (48): 13791-13796. https://doi.org/10.1073/pnas.1610725113
Vermeij, M. J., I. Van Moorselaar, S. Engelhard, C. Hornlein, S. M. Vonk y P. M. Visser. 2010. The effects of nutrient enrichment and herbivore abundance on the ability of turf algae to overgrow coral in the Caribbean. PLoS ONE, 5 (12): e14312 https://doi.org/10.1371/journal.pone.0014312
Welsh, J. Q., R. M. Bonaldo y D. M. Bellwood. 2015. Clustered parrotfish feeding scars trigger partial coral mortality of massive Porites colonies on the inshore Great Barrier Reef. Coral Reefs, 34 (1): 81-86. https://doi.org/10.1007/s00338-014-1224-4
