INTRODUCCIÓN
Historiadores reflejan en sus escritos disímiles productos que fueron utilizados en la antigüedad para el control de plagas. La mayoría partieron de extractos de pimiento, agua jabonosa, vinagre, trementina, aceite de pescado, salmuera, cenizas, azufre, compuestos arsenicales y tabaco molido, entre otros (Ware y Whitacre, 2004). Es en el año 400 a. C., en Persia, cuando se describió la utilización para el control de piojos del polvo obtenido de flores secas de Tanacetum cinerariaefolium (Trevir.) Sch. Bip. del cual posteriormente se originaron los insecticidas piretroides sintéticos. Con el transcurso del tiempo y con la producción a gran escala de plaguicidas sintéticos, esta propiedad de las plantas perdió importancia para los seres humanos.
Los mosquitos, dentro de la fauna entomológica, constituyen uno de los grupos de mayor importancia médica por su papel preponderante en la transmisión de enfermedades al hombre y a los animales (World Health Organization [WHO], 2017). Ante la ausencia de vacunas efectivas, contra las arbovirosis que anualmente se incrementan en la región de las Américas, la medida más utilizada para reducir las poblaciones de mosquitos, lo constituye, la aplicación de insecticidas.
Por su falta de especificidad, la utilización de insecticidas sintéticos afecta al medio ambiente, acumulándose por bioconcentración en los distintos eslabones de la cadena alimenticia, suelo y agua, sin restarle importancia a la destrucción de la fauna acompañante e integrante del ecosistema que ve afectado su normal comportamiento (Soares y Porto, 2012). La sucesión y el reemplazo de especies, resistencia y cambios de conducta de los vectores (Suárez et al., 1999, 2002) y la eliminación de agentes de control biológico natural, son ejemplos del daño ecológico que trae consigo el uso de los plaguicidas (Aliferis y Jabaji, 2011).
Como consecuencia de estos aspectos, en los últimos años la Organización Mundial de la Salud (OMS) motiva la búsqueda e implementación de nuevas alternativas de control (WHO, 2017) que permitan disminuir el uso de los insecticidas convencionales. Dentro de la comunidad científica se experimenta un creciente interés en el estudio de las plantas como fuente de materia prima para la obtención de productos naturales más inocuos y sustentables (Isman 2016; Andrade-Ochoa et al., 2017) lo que constituye un abordaje novedoso con posibles aplicaciones prácticas no solo en Cuba, teniendo en cuenta los escasos estudios realizados, sino también en las Américas (Leyva et al, 2017).
OBJETIVO
- Evaluar la actividad insecticida de los aceites esenciales de Piper aduncum subsp. ossanum (Piperaceae), y Ocimum basilicum (Lamiacaeae) sobre Aedes (Stegomyia) aegypti (Linnaeus, 1762), Aedes (Stegomyia) albopictus (Skuse, 1894) y Culex (Culex) quinquefasciatus Say, 1823.
MATERIALES Y MÉTODOS
Para el estudio se utilizaron tres especies de mosquitos distribuidas en cuatro poblaciones.
Cepa Rockefeller. Especie Ae. aegypti, cepa de referencia de laboratorio susceptible a insecticidas, suministrada por el Centro para el Control y la Prevención de Enfermedades (CDC), San Juan, Puerto Rico, desde el año 1996.
Población Marianao 2013. Especie Ae. aegypti, colectada en el año 2013, en estado de larva y pupa, en el municipio Marianao, La Habana, Cuba.
Población Fraga 2012. Especie Ae. albopictus, colectada en el año 2012 en estado de larva y pupa en larvitrampa en el municipio La Lisa, La Habana, Cuba.
Población Baraca 2014. Especie Cx. quinquefasciatus, colectada en el año 2014 en estado de larva y pupa, en zanja ubicada en el municipio La Lisa, La Habana, Cuba.
Aceites esenciales utilizados en el estudio. Los aceites esenciales utilizados fueron suministrados por Instituto de Farmacia y Alimentos (IFAL) de la Universidad de la Habana, Cuba.
Ocimum basilicum (L.), (Lamiacaeae), nombre común: albahaca. Se recolectó en diciembre de 2014 en el IFAL. Se herborizó un ejemplar representativo que se depositó en el Jardín Botánico Nacional de Cuba HFC-087057. Piper aduncum subsp. ossanum (C. DC.), Saralegui (Piperaceae), nombre común: platanillo. Fue colectado en septiembre de 2013, en la provincia Artemisa. Se herborizó un ejemplar representativo que fue depositado en el Jardín Botánico Nacional de Cuba: HFC-87641.
Todos los aceites se extrajeron utilizando destilación por arrastre al vapor de las hojas y la identificación de los componentes se determinó por cromatografía gaseosa acoplada a espectrometría de masa (CG-EM). Los aceites esenciales se mantuvieron a 4 °C hasta la preparación de la solución para el bioensayo correspondiente.
Determinación de la actividad larvicida de los aceites esenciales sobre Ae. aegypti, Ae. Albopictus y Cx. quinquefasciatus. Para la evaluación de la actividad larvicida de los aceites esenciales utilizados en el estudio se utilizó la metodología de la Organización Mundial de la Salud (WHO, 2005). De cada aceite se prepararon diferentes concentraciones etanólicas, de manera que, al añadir 1 mL en 99 mL de agua declorinada, se lograron concentraciones finales que oscilaron entre 8 y 150 mg/L. Por cada concentración evaluada, se utilizaron 125 larvas de tercer estadio tardío o cuarto temprano distribuidas en un control y cuatro réplicas, a razón de 25 larvas por recipiente. Se utilizó como control positivo temefos grado técnico y como control negativo 1 mL de etanol en 99 mL de agua. Transcurridas 24 horas de añadir las concentraciones se determinó la mortalidad. Se tomó como criterio de mortalidad la ausencia de nado, incapacidad para flotar, movimientos muy lentos o la inmovilidad de las larvas ante el estímulo de una aguja enmangada. Las concentraciones letales 50 (CL50) y 90 (CL90) se calcularon utilizando la prueba Probit del programa estadístico SPSS (versión 11 para Windows), teniendo en cuenta el número de individuos muertos por concentración.
Se tuvo en cuenta el criterios de Kiran et al. (2006), según el cual un aceite con una CL50 < 100 mg/L presenta una significativa actividad larvicida. Se escogió como criterio de similitud el solapamiento de los límites de confiabilidad de las CL50 calculadas.
Determinación de la actividad adulticida de aceites esenciales mediante botellas impregnadas sobre Ae. aegypti, Ae. albopictus y Cx. quinquefasciatus. Los bioensayos se realizaron siguiendo el protocolo de las botellas impregnadas (Centro para el Control y Prevención de Enfermedades [CDC], 2010), modificado por la utilización de botellas de vidrio de 250 mL de capacidad con tapa esmerilada (Rodríguez et al., 2017). El tiempo diagnóstico (TD) se estableció para 30 min según metodología establecida (CDC, 2010). Se aplicó 1 mL de las soluciones de los aceites a diferentes concentraciones a cada botella y se rotó hasta la total evaporación del disolvente. El control se impregnó con un 1 mL de acetona. Las botellas, culminada la impregnación, se cubrieron con papel de aluminio y se taparon por 24 horas. Se utilizó un control y cuatro réplicas por concentración a evaluar.
Para los bioensayos se colocaron 15 hembras de uno a tres días de emergidas en cada botella, comenzando por el control. Durante 1 hora los individuos se observaron y se registró el número de derribados cada 5 min. Transcurrido 60 min, se consideraron muertos aquellos mosquitos que no pudieron volar cuando se movía la botella con suavidad o los que se mantuvieron inmóviles en el fondo de la botella.
Con los valores del número de individuos derribados cada 5 min, a la dosis mínima de cada aceite que provocó el 100 % de derribo a los 30 min se calcularon, los tiempos de derribo que provocaron el 50 y el 90 % de derribo (TD50 y TD90) para cada población. Estos parámetros se calcularon mediante la prueba Probit.
Determinación de la actividad adulticida mediante papeles impregnados con soluciones de aceites esenciales. Para la realización de los bioensayos se impregnaron papeles de filtro (12 x 15cm) con soluciones cetónicas a igual concentración que las utilizadas con las botellas. Se impregnó con 2 mL de solución, de forma manual utilizando una pipeta volumétrica de 1 mL. En cada tubo se colocaron en su interior 20 hembras de tres días de emergidas, sin alimentar, comenzando por el control. Cada concentración contó con un control y cuatro réplicas por población utilizada en el estudio. Todos los individuos se expusieron por un periodo de 1 hora según la metodología (WHO, 2016). Al final del período de exposición, los mosquitos adultos se transfirieron a tubos de reposo y mantenidos en posición vertical por 24 horas. Los tiempos de derribo que provocaron el 50 y el 90 % de derribo (TD50 y TD90) para cada población se calcularon con el número de individuos derribados cada 5 min, a la dosis mínima de cada aceite que provocó el 100 % de derribo a los 30 min. Estos parámetros se obtuvieron mediante la prueba Probit. Como controles positivos para ambos bioensayos se utilizaron papeles impregnados con malation al 5 % por ser la dosis diagnóstico más alta que describen los informes de la OMS.
RESULTADOS
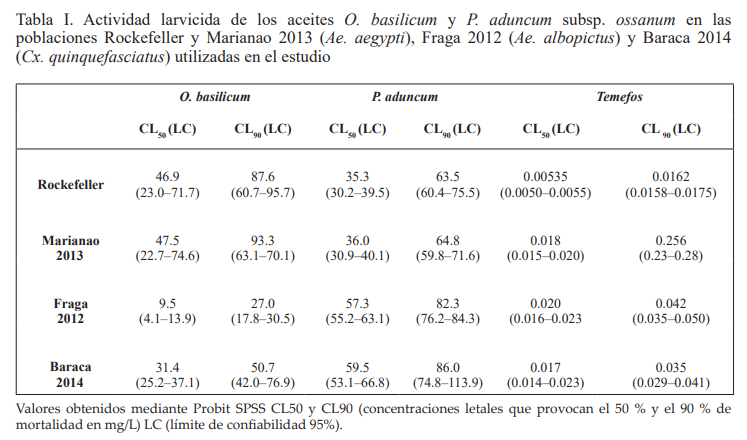
Actividad larvicida de aceites esenciales sobre Ae. aegypti, Ae. albopictus y Cx. quinquefasciatus. En la Tabla I se muestran los resultados obtenidos en la evaluación de la actividad larvicida de los aceites esenciales estudiados. Los aceites evaluados evidenciaron una actividad larvicida significativa sobre las cuatro poblaciones estudiadas, al presentar CL50 inferiores a 100 mg/L. En la cepa Rockefeller (Ae. aegypti) se destaca que las CL50 calculadas presentaron valores inferiores a 50 mg/L. Aedes albopictus mostró alta sensibilidad al aceite de O. basilicum (9.5 mg/L), que no se destacó entre los aceites de mayor actividad larvicida sobre Ae. aegypti; mientras que para Cx. quinquefasciatus la respuesta a este aceite se triplicó (31.4 mg/L).
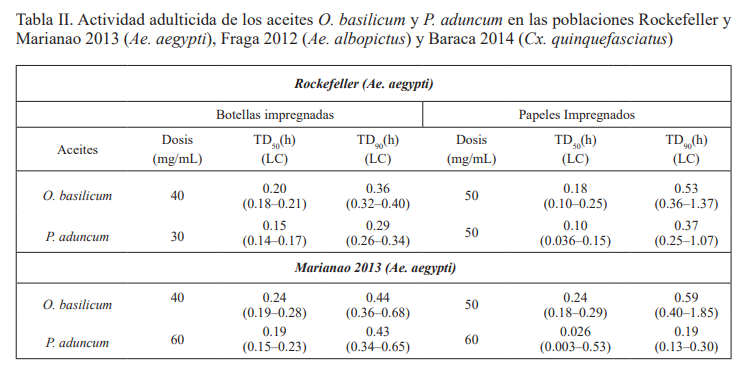
Actividad adulticida mediante botellas y papeles impregnadas con soluciones de aceites esenciales. En la Tabla II se muestran los resultados obtenidos al evaluar la actividad adulticida, de los aceites estudiados mediante las dos metodologías utilizadas.
Para la cepa Rockefeller (Ae. aegypti), P. aduncum subsp. ossanum mostró la mayor actividad adulticida con la dosis de 30 mg/mL utilizando botellas impregnadas y con O. basilicum se logró el 100 % de derribo a los 30 min con 40 mg/mL. Para Marianao 2013 (Ae. aegypti), el aceite más efectivo fue O. basilicum, utilizando 40 mg/mL, mientras que al evaluar P. aduncum subsp. ossanum, se logró el derribo con 60 mg/mL.
Utilizando los papeles impregnados, para O. basilicum se evidenció un aumento de la dosis de aceite para derribar el 100 % de los adultos de esa población.
Tabla I. Actividad larvicida de los aceites O. basilicum y P. aduncum subsp. ossanum en las poblaciones Rockefeller y Marianao 2013 (Ae. aegypti), Fraga 2012 (Ae. albopictus) y Baraca 2014 (Cx. quinquefasciatus) utilizadas en el estudio
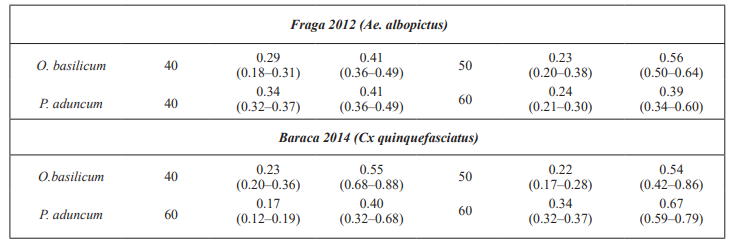
Para Fraga 2012 (Ae. albopictus) los aceites estudiados mostraron actividad adulticida a la dosis de 40 mg/mL con botellas impregnadas y en el caso de los papeles impregnados, O. basilicum, manifestó actividad adulticida a 50 mg/mL.
Los estudios realizados con Baraca 2014 (Cx. quinquefasciatus) ambos aceites evidenciaron por el método de las botellas impregnadas actividad adulticida a la dosis de 40 mg/mL mientras que con el aceite de O. basilicum en papeles impregnados ocurrió un incremento de la dosis a 50 mg/mL y en el caso de P. aduncum subsp. ossanum a 60 mg/mL.
DISCUSIÓN
Actividad larvicida de aceites esenciales sobre Aedes aegypti, Aedes albopictus y Culex quinquefasciatus
Ocimunm basilicum (albahaca) es una hierba aromática cuyo aceite esencial, fresco o seco, puede usarse habitualmente como aditivo para el aroma en la comida, cosméticos, o farmacéuticos (Javanmardi et al., 2002; Rivas et al.,2015). Una propiedad adicional de esta planta es su actividad larvicida demostrada sobre Cx. quinquefasciatus por Pavela (2008), obteniendo una CL50 = 32 mg/L; y sobre Culex tritaeniorhynchus Giles, 1901 (CL50=14.01 mg/L), Ae. albopictus (CL50 = 11.97 mg/L) y Anopheles subpictus Grassi, 1899 (CL50 = 9.75 mg/L) por Govindarajan et al. (2013). Los resultados obtenidos para la población Fraga 2012 confirman la actividad larvicida del aceite de O. basilicum sobre Ae. albopictus. Sin embargo los estudios realizados por Giatropoulos et al. (2018), muestran una CL50 muy superiores a las calculadas para esta especie de mosquito (107,7 mg/L [98,7–116,2 mg/L]).
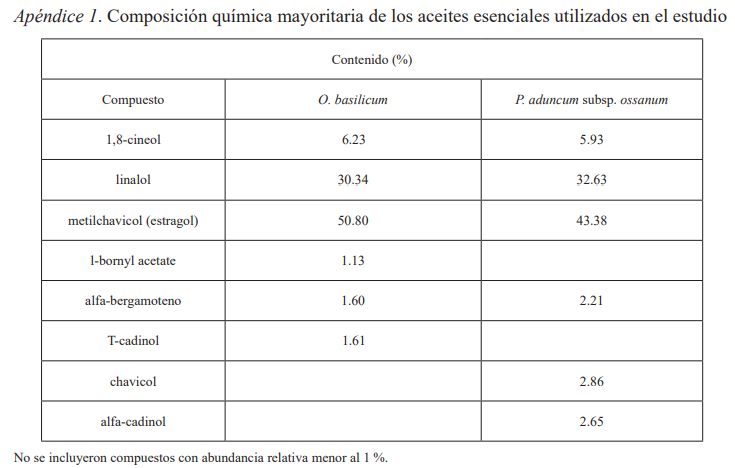
Los aceites de albahaca se caracterizan por el predominio general de monoterpenos oxigenados y derivados fenilpropanoides, entre los componentes mayoritarios más comunes se encuentran el linalol, estragol (metilchavicol), anetol, eugenol y metil eugenol, variando por quimiotipo, condiciones edafoclimáticas, de cultivo extracción, entre otros factores (Preedy, 2016). Los estudios realizados a O. basilicum en Nepal destacan el linalol (47.2 %), estragol (31.7 %) y pulegona (4.8 %); en Yemen, el aceite de esta planta presenta linalol (74.5 %), 1.8-cineol (7.4 %) y estragol (7.2 %), (Sharopov et al., 2016). Giatropoulos et al. (2018) informan como compuestos mayoritarios 1.8-cineol (7.2 %), linalol (35.2 %), metilchavicol (16.3 %), b-elemeno (3.5 %), eugenol (2.5 %), entre otros.
En la esencia de albahaca, evaluada en el presente trabajo, se identificaron como componentes mayoritarios el estragol (50.80 %), linalol (30.34 %) y el 1.8-cineol (6.23 %), (Apéndice 1). El aceite cubano tiene similitudes con los procedentes de Yemen y Nepal dadas por la presencia común de estos compuestos.
El estragol y el linalol poseen antecedentes de acción insecticida sobre larvas del mosquito Cx. quinquefasciatus (CL50 = 14.01 mg/L, [11.68–16.45 mg/L] y CL50 = 42.28 mg/L [35.64–49.25 mg/L], respectivamente) y Ae. aegypti (CL50 = 12.70 mg/L [10.15-15.26 mg/L] y CL50 = 38.64 mg/L [30,42- 46,97 mg/L], respectivamente), (Govindarajan, 2010). Sin embargo, en los estudios realizados por Giatropoulos et al. (2018) la CL50 calculada para linalol sobre Ae. albopictus fue muy superior a los estudios precedentes (169.6 mg/L [157.7–184.2 mg/L]). De igual forma, Sousa et al., (2015) demostró que el estragol también es tóxico para Anopheles atroparvus Van Theil, 1927 (CL50= 56.1 mg/L, [52.2–60.0 mg/mL]). La presencia de estos compuestos en el aceite estudiado pudiera asociarse a la actividad insecticida de esta planta en las especies de mosquito.
En la mayoría de la literatura consultada sobre P. aduncum, se le nombra sin especificar si se trata de una subespecie o variedad, el aceite estudiado es obtenido a partir de P. aduncum subsp. ossanum, una subespecie endémica en Cuba occidental (Saralegui, 2004), por lo que estos resultados son los primeros que se obtienen para la región de las Américas en general, y el Caribe en particular.
Los valores de actividad larvicida obtenidos en nuestro estudio para este aceite sobre las poblaciones de Ae. aegypti, son mucho menores que los obtenidos por Oliveira et al. (2013) (CL50= 289.9 mg/L). Sin embargo, de Almeida et al. (2009) obtuvieron una CL50 = 54.5 mg/L (51.1–57.8 mg/L) para larvas de Ae. aegypti a las 24 horas de expuestas, que fue superior a los obtenidos para la cepa Rockefeller y la población Marianao 2013. La variación en los resultados puede estar relacionada por factores entre los que se incluyen la composición química de los aceites.
Aunque la mayoría de las investigaciones relacionadas con la composición química del aceite esencial de P. aduncum coinciden con la presencia mayoritaria de dilapiol, este fenilpropanoide no se identificó entre los componentes con mayor abundancia relativa en el aceite evaluado (Apéndice 1). En Colombia, P. aduncum revela 25.8 % de dilapiol, además de 1,8-cineol (20 %) y α-pineno (Bottia et al., 2007) y en Ecuador además de α y β pineno, 1,8 cineol, 4 terpineol, el 10.34 % corresponde a E-ocimeno y el 42.9 % de dilapiol (Guerrini et al., 2009); de Almeida et al. (2009) plantea como componente mayoritario el dilapiol (86.9 %). El análisis realizado por Oliveira et al. (2013) arrojó 1,8-cineol (53.9 %), además, de α-pineno (12.7 %), β-pineno (8.5 %) y trans-ocimeno (5.7 %). En Cuba, P. aduncum subsp. ossanum muestra en su composición canfeno, alcanfor, piperitona y el viridiflorol (Pino et al., 2011). En estudios posteriores realizados por Gutiérrez et al. (2016) confirma la presencia de canfeno (5.39-7.41 %), alcanfor (9.41-13.87 %), piperitona (19.0–20.0 %) y viridiflorol (12.97–18.80 %). Es probable que las causas de las diferencias en su composición química estén asociadas a factores genéticos y ambientales que conlleven a variaciones en la biosíntesis de metabolitos secundarios en esta subespecie y consecuentemente incidan en la actividad larvicida.
Actividad adulticida de los aceites esenciales mediante las metodologías de papeles y botellas impregnadas sobre Ae. aegypti, Ae. albopictus y Cx. quinquefasciatus
En la literatura consultada se referencia un estudio sobre Ae. aegypti utilizando botellas impregnadas con extractos y el aceite esencial de O. basilicum (Huaman, 2019). No obstante, no se encontraron estudios precedentes sobre la actividad adulticida de O. basilicum, sobre poblaciones de Ae. albopictus y Cx quinquefasciatus para las Américas, y el Caribe en particular, como tampoco para P. aduncum subsp. ossanum, al ser esta, una especie endémica, en nuestro país. Los resultados obtenidos son novedosos para estas plantas y aumenta el conocimiento sobre estas como fuente de sustancias con acción plaguicida.
El aceite de P. aduncum subsp. ossanum no se destacó por su efecto letal sobre los adultos de las especies estudiadas. Aunque, si se evidenció que por el método de las botellas la dosis de derribo fue 20 mg menor en la cepa Rockefeller (Ae. aegypti) y Ae. albopictus. Misni et al. (2011) observaron que el aceite de P. aduncum formulado (10 %) con keroseno y aplicado en forma de aerosol provocó 74.8 % y 72.4 % de derribo en Ae. aegypti y Ae. albopictus, respectivamente, transcurridos 20 min. El análisis de estos resultados y los obtenidos en el presente trabajo utilizando dos métodos evaluación (botellas y papel) indica que la forma de aplicación o exposición puede influir en la actividad adulticida de este aceite. También, debe considerarse la posible incidencia en los resultados de la formulación. La composición química del aceite cubano es diferente a la de los aceites de P. aduncum más estudiados y por ende otro elemento a tomar en cuenta como causa de las diferentes respuestas biológicas evidenciadas en los dos estudios.
La diferencia en las dosis por metodologías utilizadas puede estar dada, en primer lugar, por la hermeticidad de las botellas lo que favorece y potencia la acción fumigante de la fase de vapor de los aceites. En el caso de los papeles, al ser colocados dentro de dispositivos a fines, la tapa del estuche permite la transferencia de vapores, por lo que en el primer caso el efecto letal se produce por asfixia y adsorción y en el segundo caso solamente por adsorción a través de los tarsos.
CONCLUSIONES
Los aceites Piper aduncum subsp. ossanum y Ocimum basilicum pueden ser considerados candidatos promisorios para el control de Aedes aegypti, Aedes albopictus y Culex quienquefasciatus, debido a que evidencian una significativa actividad larvicida en las poblaciones evaluadas, al presentar CL50 inferiores a 100 mg/L. Por ambas metodologías utilizadas todos los aceites evaluados presentan actividad adulticida. Los resultados obtenidos son los primeros reportes para la región de las Américas, incluido el Caribe.
AGRADECIMIENTOS
Al centro de Antidoping de La Habana, Cuba, por su ayuda y colaboración en los análisis cromatográficos. De igual forma hacemos extensivo nuestro agradecimiento a los revisores anónimos, por sus oportunas y acertadas sugerencias que enriquecieron el trabajo.
Literatura Citada
Aliferis, K. A. y S. Jabaji. 2011. Metabolomics-A robust bioanalytical approach for the discovery of the modes-of-action of pesticides: A review. Pesticide Biochemical Physiology, 100 (2): 105–117.
Andrade-Ochoa, S., L. Sánchez-Torres, G., Nevárez-Moorillón, A. Camacho y B. NoguedaTorres. 2017. Aceites esenciales y sus componentes como una alternativa en el control de mosquitos vectores de enfermedades. Biomédica, 37 (2): 224–43.
Bottia, E., O. Díaz, D. Mendivelso, J. Martínez y E. Stashenko. 2007. Comparación de la composición química de los metabolitos secundarios volátiles de cuatro plantas de la familia Piperaceae obtenidos por destilación-extracción simultánea. Scientia et Technica, 13: 913–18.
Center for Disease Control (CDC). 2010. Guideline for evaluating insecticide resistance in rectors using the CDC Bottle Bioassay. En: G. Brogdon, & B. H. Chan, (Eds.), 2010; primera edición: Centers for Disease Control and Prevention.
De Almeida, R. R. P., R. N. P. Souto, C. N. Bastos, M. H. L. Silva y J. G. S. Maia. 2009. Chemical Variation in Piper aduncum and biological properties of its dillapiole-rich essential oil. Chemistry & Biodiversity, 6: 1427–1434.
Giatropoulos, A., A. Kimbaris, A. Michaelakis, D. Papachristos, M. G. Polissiou y E. Nickolaos. 2018. Chemical composition and assessment of larvicidal and repellent capacity of 14 Lamiaceae essential oils against Aedes albopictus. Parasitol Research, 117: 1953–1964.
Govindarajan, M. 2010. Chemical composition and larvicidal activity of leaf essential oil from Clausena anisata (Willd.) Hook. f. ex Benth (Rutaceae) against three mosquito species. Asian Pacific Journal of Tropical Medicine, 874–877.
Govindarajan, M., R. Sivakumar, M. Rajeswary y K. Yogalakshm. 2013. Chemical composition and larvicidal activity of essential oil from Ocimum basilicum (L.) against Culex tritaeniorhynchus, Aedes albopictus and Anopheles subpictus (Diptera: Culicidae). Experimental Parasitology, 134: 7–11.
Guerrini, A., G. Sacchetti, D. Rossi, G. Paganetto, M. Muzzoli, E. Andreotti, M. Tognolini, M. E. Maldonado y R. Bruni. 2009. Bioactivities of Piper aduncum L. and Piper obliquum Ruiz & Pavon (Piperaceae) essential oils from Eastern Ecuador. Environmental Toxicology and Pharmacology, 27: 39–48.
Gutiérrez, Y., R. Montes, R. Scull, A. Sanchez, P. Cos, L. Monzote y W. N. Setzer. 2016. Chemodiversity associated with cytotoxicity and antimicrobial activity of Piper aduncum var. ossanum. Chemistry & Biodiversity, 13: 1715–19.
Huaman, E. A. 2019. Actividad biocida de las sustancias bioactivas de Azadirachta indica y Ocimum basilicum sobre adultos de Aedes aegypti Trujillo Perú. Tesis para optar por el grado de Master En Ciencias. Universidad Nacional de Trujillo, 2019.
Isman, M. B. 2016. Pesticides Based on Plant Essential Oils: Phytochemical and Practical Considerations. Cornell University, 2016. Disponible en: http://pubs.acs.org (accesado: agosto 25, 2016), doi: 10.1021/bk-2016-1218.ch002.
Javanmardi, J., A. Khalighi, A. Kashi, H. P Bais y J. M. Vivanco. 2002. Chemical characterization of Basil (Ocimum basilicum (L.) found in local accessions and used in traditional medicines in Iran. Journal Agricol Food Chemical, 50 (21): 5878–5883.
Kiran, S. R., K. Bhavani, P. S. Devi, B. R. R. Rao y K. J. Reddy. 2006. Composition and larvicidal activity of leaves and stem essential oils of Chloroxylon swietenia DC against Aedes aegypti and Anopheles stephensi. Bioresource Technology, doi:10.1016/j.biortech.2005.10.003.
Leyva, M., L. French, O. Pino, D. Montada, G. Morejón, M. Castex y M. C. Marquetti. 2017. Plantas con actividad insecticida: una alternativa natural contra mosquitos. Estado actual de la temática en la región de las Américas. Revista Biomedica, 28 (3):137–149.
Misni, N., Othman, H. y S. Sulaiman. 2011. The effect of Piper aduncum Linn. (Family: Piperaceae) essential oil as aerosol spray against Aedes aegypti (L.) and Aedes albopictus (Skuse). Tropical Biomedicin, 28 (2): 249–258.
Oliveira, G., S. Cardoso, C., Lara, T., Vieira, E., Guimarães, L., Figueiredo, E., Martins, D., Moreira y M. Kaplan. 2013. Chemical study and larvicidal activity against Aedes aegypti of essential oil of Piper aduncum L. (Piperaceae). Anais da Academia Brasileira de Ciências, 85 (4): 1227–1234.
Pavela, R. 2008. Insecticidal properties of several essential oils on the house fly (Musca domestica (L.). Phytotherapy Research, 22: 274–78.
Pino, O., Y. Sánchez, H. Rodríguez, T. M. Correa, J. Demedio y J. L. Sanabria. 2011. Caracterización química y actividad acaricida del aceite esencial de Piper aduncum subsp. ossanum frente a Varroa destructor. Revista Protección Vegetal, 26 (1). Preedy, V. 2016. Essential Oils in Food Preservation, Flavor and Safety. Edited by Victor R. Preedy. Elsevier 2016.
Rivas, K., C. Rivas y L. Gamboa. 2015.Composición química y actividad antimicrobiana del aceite esencial de albahaca (Ocimum basilicum). Multiciencias,15 (3):281–89.
Rodríguez, M. M., A. Crespo, D. Hurtado, I. Fuentes, J. Rey y J. A. Bisset. 2017. Diagnostic doses of insecticides for adult Aedes aegypti to assess insecticide resistance in Cuba. Journal American Mosquito Control Association, 33 (2):142–144.
Saralegui, B. H. 2004. Flora de la República de Cuba. Piperaceae. Fascículo 9 (3): 1–5.
Sharopov, F., P. Satyal, A. Nasser, A. Awadh, S. Pokharel, H. Zhang, M. Wink, A. Muhammadsho y W. N. Setzer. 2016. The Essential Oil Compositions of Ocimum basilicum from three different Regions: Nepal, Tajikistan, and Yemen Chem. Biodiversity, 13: 241–248.
Sousa, R. M. O. F., J. S. Rosa, C. A. Silva, M. T. M. Almeida, M. T. Novo, A. C. Cunha y M. Fernandes-Ferreira. 2015. Larvicidal, molluscicidal and nematicidal activities of essential oils and compounds from Foeniculum vulgare. Journal Pesticide Science, 88 (2): 413–26.
Soares, W. L. y M. F. S. Porto. 2012. Pesticide use and economic impacts on health. Revista Saúde Pública, 46: 209–217.
Suárez, S., D. Montada, O. Fuentes, M. Castex y M. Leyva. 1999. Efecto de la resistencia a los insecticidas sobre algunos parámetros demográficos de 3 cepas de Culex quinquefasciatus (Diptera: Culicidae) en condiciones de laboratorio. Revista Cubana Medicina Tropical, 50 (2): 124–8.
Suárez, S., D. Montada, M. Castex, A. Navarro y M. Leyva. 2002. Efecto de las dosis subletales de temefos sobre la supervivencia, reproducción y crecimiento poblacional de Aedes aegypti. Revista Latinoamericana Microbiologia, 44 (4), oct- dic, 2002 .MX. ISSN. 00349771.
Ware, G.W. y D. M. Whitacre. 2004. The Pesticide Book. 6th Ed. 496 pp. Meister Media Worldwide, Willoughby, Ohio. (ISBN: 1892829-11-8).
World Health Organization (WHO). 2005. Guidelines for laboratory and field testing of mosquito larvicides. WHO/CDS/WHOPES/GCDPP/2005.13.
World Health Organization (WHO). 2016. Monitoring and managing insecticide resistance in Aedes mosquito populations Interim guidance for entomologists 2016. WHO/ZIKV/ VC/16.1.
World Health Organization (WHO). 2017. Integrating neglected tropical diseases in to global health and development: fourth WHO report on neglected tropical diseases. 2017. Disponible en: http://www.who.int/neglected_diseases/enWHO/HTM/NTD/2017.01 (acessado: abril 2017).