INTRODUCCIÓN
Las enfermedades transmitidas por vectores representan más del 17 % de todas las enfermedades infecciosas, y provocan cada año más de 700 000 defunciones (Organización Mundial de la Salud [OMS], 2017). Entre estas, las arbovirosis constituyen un gran reto para la salud global por su diversidad genética y evolutiva, así como por su potencialidad para causar infecciones graves, no solo en las personas sino también en animales (Alarcón-Elbal et al., 2017). Muchas de estas enfermedades presentan una gran incidencia en regiones tropicales y subtropicales, provocando infecciones subclínicas o inespecíficas (Gould y Solomon, 2008), lo que a la postre dificulta no sólo su diagnóstico, sino también su tratamiento y control.
La especie de mosquito de mayor notoriedad, por involucrarse protagónicamente en la transmisión de enfermedades como la fiebre amarilla, dengue, chikungunya o, más recientemente, el Zika, es Aedes (Stegomyia) aegypti (Linnaeus, 1762) (Diptera: Culicidae). La relevancia actual de los patógenos que puede transmitir este díptero es enorme, tanto que aparecen brotes epidémicos de estas enfermedades cada vez más intensos y reiterados en países tropicales, como sucede con el dengue y su forma clínica más severa, el dengue grave (San Martín y Brathwaite-Dick, 2007). Se estima que, en la presente década, la carga de morbilidad se incrementará notablemente con más de dos millones en América Latina (Organización Panamericana de la Salud [OPS], 2014).
Este mosquito sinantrópico, que se reproduce generalmente en reservorios de agua de pequeño y mediano tamaño, aprovecha la amplia gama de depósitos artificiales existentes del entorno doméstico para el desarrollo de sus formas preimaginales. Por tanto, es necesario disponer de conocimientos actualizados sobre la bioecología de este y otros mosquitos vectores, con objeto de diseñar e implementar estrategias integrales de control (Diéguez Fernández et al., 2013).
OBJETIVOS
- El presente estudio pretende actualizar el conocimiento de los hábitats preferenciales de cría de Ae. aegypti en Jutiapa, con el propósito de diseñar y establecer medidas de vigilancia y control más acertadas.
MATERIALES Y MÉTODOS
Área de estudio. El estudio se realizó en el Departamento de Jutiapa, que tiene una extensión territorial aproximada de 3 219 km2, y se encuentra situado en la región sur-oriente de la República de Guatemala. El Departamento cuenta con una población estimada en 444 434 habitantes, de la cual el 84 % dispone de agua potable, el 6 % de agua de acueducto y el 10 % restante no tiene este tipo de servicio, por lo que se ve obligada a acumularla, generalmente en depósitos no hermetizados. Su clima es muy diverso, entre cálido y templado. Sus límites geográficos son: al norte con los Departamentos de Jalapa y Chiquimula; al sur con el Departamento de Santa Rosa y el océano Pacífico; al este con la República de El Salvador; y al oeste con el Departamento de Santa Rosa (Fig. 1).
Período de estudio y obtención de los datos. Se realizó un estudio descriptivo y retrospectivo mediante la revisión documental del registro de muestras del Laboratorio de Entomología Departamental (LED) de Jutiapa, en el periodo comprendido entre enero de 2010 y diciembre de 2017. Las inspecciones se realizaron con una periodicidad trimestral en el intra y peridomicilio, abarcando el máximo posible del universo urbano y rural (viviendas y terrenos baldíos), en los 17 municipios del Departamento.
Captura e identificación de los estados preimaginales. El material biológico fue capturado según las normas y técnicas establecidas en Guatemala (Ministerio de Salud Pública y Asistencia Social [MSPAS], 2015). Las formas preimaginales fueron removidas de los reservorios con la ayuda de pipetas Pasteur y bandejas plásticas, y fijadas acto seguido en alcohol al 70 % dentro de botes herméticos, adjuntando identificación precisa del tipo de depósito del que fue capturado, lugar y fecha de captura, según el modelo de clasificación de muestras larvarias, que es el establecido en Guatemala para el Programa Nacional de Enfermedades Transmitidas por Vectores. Los estados preimaginales capturados fueron remitidos y clasificados en el LED del Programa de Enfermedades Transmitidas por Vectores de Jutiapa, mediante la utilización de lupa binocular y microscopio y según los trabajos de Clark-Gil y Darsie (1983) y González Broche (2006).
Clasificación de los depósitos. Los términos «depósito útil» y «depósito no útil» estuvieron sistematizados de acuerdo al uso que diariamente les asigna la población, así como de la importancia que esta les concede, y como «depósito natural» a las diferentes formas en las que podemos encontrar almacenada el agua en la naturaleza y medio ambiente, como por ejemplo los ambientes fitotélmicos (MSPAS, 2015).
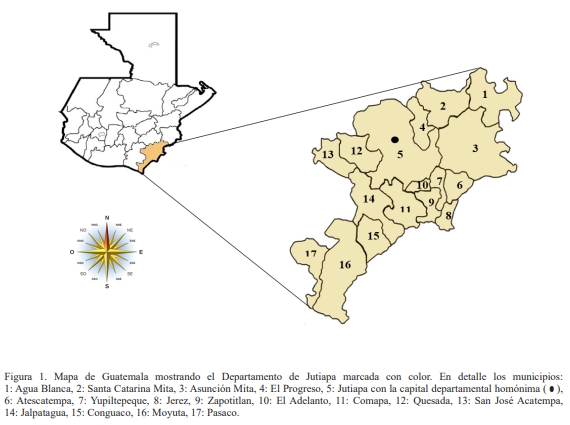
Figura 1. Mapa de Guatemala mostrando el Departamento de Jutiapa marcada con color. En detalle los municipios:. 1: Agua Blanca, 2: Santa Catarina Mita, 3: Asunción Mita, 4: El Progreso, 5: Jutiapa con la capital departamental homónima ( ), 6: Atescatempa, 7: Yupiltepeque, 8: Jerez, 9: Zapotitlan, 10: El Adelanto, 11: Comapa, 12: Quesada, 13: San José Acatempa, 14: Jalpatagua, 15: Conguaco, 16: Moyuta, 17: Pasaco.
RESULTADOS
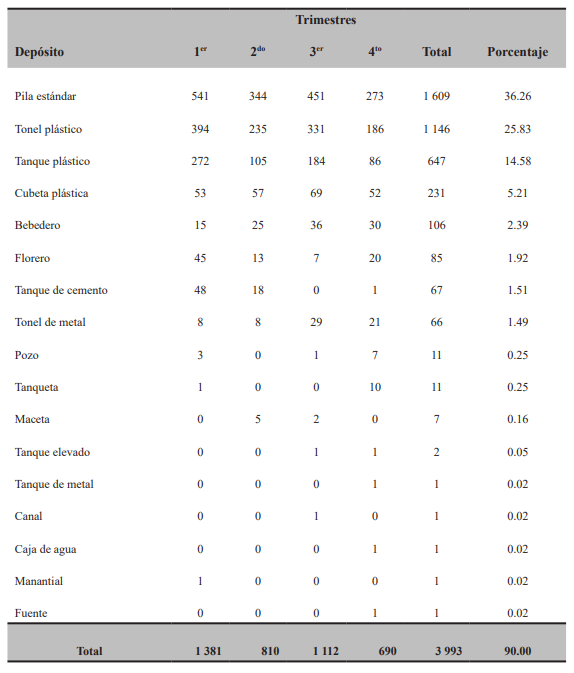
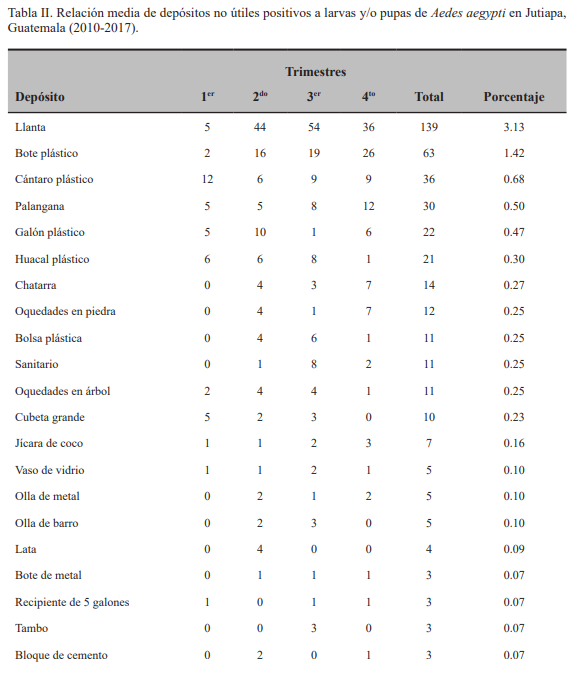
Se reportaron 56 tipos de depósitos diferentes positivos a larvas y/o pupas de Ae. aegypti, atendiendo a su utilidad en el contexto doméstico, de los cuales 17 fueron útiles, para un 30.35 % (Tabla I). Sin embargo, los depósitos útiles, siendo minoría en comparación con los no útiles, aunaron el 90.00 % de total de depósitos con presencia del mosquito, que fueron 3 993 de un total de 4 427, lo que denota su importancia en relación a los focos positivos reportados (Figs. 2A y 2B).
Se observó que la pila estándar aportó el 36.26 % de los depósitos positivos durante los ocho años de estudio (1 609 de 4 427 capturas), así como en los cuatro trimestres analizados (Tabla I). Este depósito es utilizado por las familias para acumular agua con diversos y vitales usos domésticos, exceptuando el de beber, como por ejemplo lavar ropa. Hay una gran variedad de forma y constitución, pudiendo ser de cemento, mármol, cerámica o plástica, entre otras.
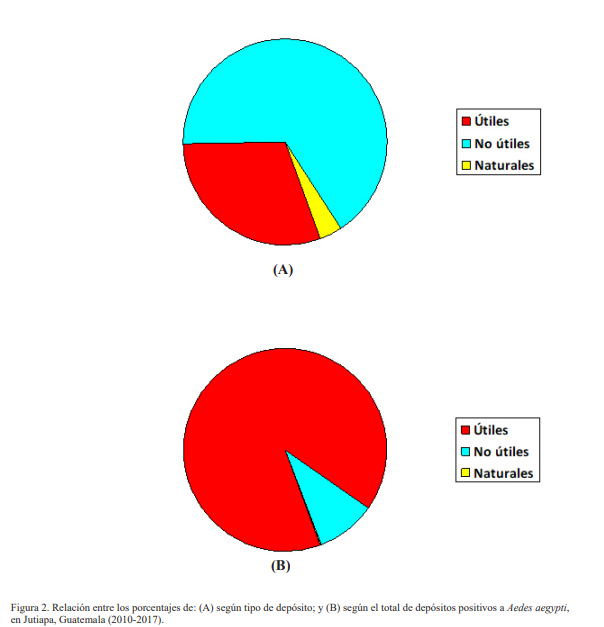
Tabla I. Relación promedio de depósitos útiles positivos a larvas y/o pupas de Aedes aegypti en Jutiapa,
Guatemala (2010-2017)
DISCUSIÓN
La República de Guatemala presenta todas las características epidemiológicas y ambientales para la transmisión de enfermedades vectoriales, entre las que destaca el dengue, cuyo vector es Ae. aegypti (OPS/OMS, 2018). En este país, recientemente, la pila estándar ya se ha indicado como uno de los recipientes preferentes de este aedino (Vinicio et al., 2018), mientras que en México, se ha encontrado indistintamente en grandes contenedores de agua, como tanques y piletas (Arredondo-Jiménez y Valdez-Delgado, 2006; Quintero et al., 2014), así como en pequeños como botes y cubetas (García-Rejón et al., 2011).
La presencia de este culícido en aguas con diferentes niveles de eutrofización ha sido comunicada por varios autores (Marquetti Fernández, 2006; Diéguez Fernández et al., 2009; Diéguez Fernández et al., 2010), lo que denota la amplitud del nicho ecológico de la especie, capacidad que le ha favorecido para sobrevivir en ambientes muy cambiantes, como el urbano. En Cuba, se ha reportado su presencia en fosas sépticas, arquetas, alcantarillas y drenajes (Marquetti Fernández et al., 2009), hecho que confirma los cambios conductuales que está adoptando este culícido. Asimismo, en el presente estudio se ha reportado la presencia del vector en arquetas, sanitarios, piezas de autos y chatarras, lo que ratifica dicha tendencia conductual. En República Dominicana, Peña y Zaglul (1986) lo encontraron criando en una gran cantidad de recipientes artificiales en la ciudad de Santo Domingo, como tanques, latas, vasijas plásticas, tarros y floreros; con menor frecuencia también en lagunas, huecos de arrecifes, huecos de rocas, neumáticos usados y bromelias, entre otros. En la actualidad, se ha observado a este culícido colonizando una amplia gama de residuos sólidos urbanos en el entorno público en la región del Cibao Sur (Borge de Prada et al., 2018), lo que denota que esta problemática no se restringe únicamente al ámbito domiciliario, aunque sí generalmente a una falta de ordenamiento ambiental. Además, ratificando su comportamiento oportunista y amplia plasticidad ecológica, este culícido sigue demostrado una gran versatilidad para desarrollar sus formas inmaduras en cualquier tipo de recipiente, independientemente del material que lo constituya, en lugares de gran interés epidemiológico, como son los cementerios (González et al., 2019), pero también en otros, como los ambientes fitotélmicos, alejados de las zonas urbanas (Rodríguez Sosa et al., 2019).
En la elaboración e implementación de estrategias dirigidas a la prevención y control antivectorial, es elemental dirigir las acciones hacia los depósitos que son colonizados con mayor frecuencia por las especies diana (Fajardo et al., 2001), siendo la pila estándar el de mayor prioridad en la lucha contra Ae. aegypti en el Departamento de Jutiapa. Dicho reservorio representó más de un tercio de los focos durante los ocho años de estudio, y es ampliamente utilizado, pues está presente en prácticamente todas las viviendas inspeccionadas del Departamento. Esto obliga a los operativos de la red de control de vectores, y a la población jutiapaneca, a prestar una atención diferenciada sobre dicho depósito, sobre todo en la aplicación y mantenimiento de larvicida o en la ejecución de acciones ovicidas, como el cepillado y el flameado. La relevancia de la pila estándar como foco de infestación demanda de los educadores y promotores de la salud la emisión de mensajes dirigidos a priorizar su limpieza y cobertura, propiciando la difusión de las medidas preventivas (Diéguez Fernández et al., 2010). Sin embargo, en algunos hogares se ha detectado la presencia de larvas y/o pupas en depósitos en ausencia de larvicida, a pesar de que se insta a la población en su utilización, dada su probada efectividad. Por tanto, es menester revisar y mejorar la información que se le está brindando a la población.
CONCLUSIONES Y RECOMENDACIONES
Se encontró una amplia variedad de depósitos artificiales colonizados por Ae. aegypti, principalmente los que tienen una elevada utilidad para las familias. La pila estándar resultó el recipiente clave, al representar más de un tercio de los focos positivos en el período de estudio. Se requiere revisar y mejorar la información que se le brinda a la población, para incorporarla de manera activa y consciente a la vigilancia y lucha antivectorial.
AGRADECIMIENTOS
Los autores expresan su agradecimiento a los directivos del Área de Salud de Jutiapa, al Coordinador del Programa de Enfermedades Transmitidas por Vectores de Jutiapa, Sr. David Jiménez Gudiel, así como a los operativos y cadena de mando del Departamento de Control de Vectores de Jutiapa, por su apoyo incondicional a la presente investigación. De igual forma hacemos extensivo nuestro agradecimiento a los revisores anónimos, por sus oportunas y acertadas sugerencias que enriquecieron el trabajo.
LITERATURA CITADA
Alarcón-Elbal, P. M., R. Paulino-Ramírez, L. Diéguez-Fernández, R. Fimia-Duarte, K. A. Guerrero y M. González. 2017. Arbovirosis transmitidas por mosquitos (Diptera: Culicidae) en la República Dominicana: Una revisión. The Biologist (Lima), 15 (1): 193–219.
Arredondo-Jiménez, J. I. y K. M. Valdez-Delgado. 2006. Aedes aegypti pupal/demographic surveys in southern Mexico: consistency and practicality. Annals of Tropical Medicine and Parasitology, 1: 17–32.
Borge de Prada, M., M. A. Rodríguez-Sosa, Y. E. Vásquez-Bautista, K. A. Guerrero y P. M. Alarcón-Elbal. 2018. Mosquitos (Diptera, Culicidae) de importancia médica asociados a residuos sólidos urbanos en Jarabacoa, República Dominicana. Revista Salud Jalisco, Nº Especial: 20–27.
Clark-Gil, S. y Jr. R. F. Darsie. 1983. The mosquitoes of Guatemala, their identification, distribution and bionomics, with keys to adult females and larvae in English and Spanish. Mosquito Systematics, 15: 151–284.
Diéguez Fernández, L., G. García González, N. Canino Méndez y D. Nápoles Vega. 2009. Aedes (St.) aegypti oviponiendo en macetas de plantas ornamentales. Sus probables implicaciones entomológicas. Revista Archivo Médico de Camagüey [Internet] 13(2). Recuperado de http:// scielo.sld.cu/scielo.php?script=sci_arttext&pid=S1025-02552009000200019&lng=es.
Diéguez Fernández, L., S. M. Cabrera Fernández, Y. Prada Noy, C. Cruz Pineda y R. Rodríguez de la Vega. 2010. Aedes (St.) aegypti en tanques bajos y sus implicaciones para el control del dengue en Camagüey. Revista Cubana de Medicina Tropical, 62 (2): 93–97.
Diéguez Fernández, L., I. Sosa Cabrera y A. E. Pérez Arruti. 2013. La impostergable participación comunitaria en la lucha contra el dengue. Revista Cubana de Medicina Tropical, 65 (2): 272–276.
Fajardo, P., C. A. Monje, G. Lozano, O. Realpe y L. E. Hernández. 2001. Nociones populares sobre “dengue” y “rompehuesos”, dos modelos de la enfermedad en Colombia. Revista Panamericana de Salud Pública, 10: 167–168.
García-Rejón, J. E., M. P. López-Uribe, M. A. Loroño-Pino, J. A. Farfán-Ale, M. R. Del Nájera-Vázquez, S. Lozano-Fuentes, B. J. Beaty y L. Eisen. 2011. Productive container types for Aedes aegypti immatures in Mérida, México. Journal of Medical Entomology, 48 (3): 644–650.
González, M. A., M. A. Rodríguez Sosa, Y. E. Vásquez Bautista, L. Diéguez Fernández, M. Borge de Prada, K. A. Guerrero y P. M. Alarcón-Elbal. 2019. Micro-environmental features associated to container-dwelling mosquitoes (Diptera: Culicidae) in an urban cemetery of the Dominican Republic. Revista de Biología Tropical, 67 (1), 132–145.
González Broche, R. 2006. Culícidos de Cuba. Editorial Científico Técnica, La Habana: Cuba, 184 pp.
Gould, E. A. y T. Solomon. 2008. Pathogenic flaviviruses. The Lancet, 371 (9611): 500–509.
Marquetti Fernández, M. C. 2006. Aspectos bioecológicos de importancia para el control de Aedes aegypti y otros culícidos en el ecosistema urbano [Tesis Doctoral]. Ciudad de La Habana: Instituto de Medicina Tropical “Pedro Kourí”.
Marquetti Fernández, M. C., M. Leyva Silva, J. A. Bisset Lazcano y A. García Sol. 2009. Recipientes asociados a la infestación por Aedes aegypti en el municipio La Lisa. Revista Cubana de Medicina Tropical, 61 (3): 232–238.
Ministerio de Salud Pública y Asistencia Social (MSPAS). 2015. Manual operativo de vigilancia y control entomológico de Aedes aegypti, vector del dengue y chikungunya en Guatemala. Dirección General de Regulación, Vigilancia y Control de la Salud. OPS/OMS, Ciudad de Guatemala, Guatemala, 31 pp. Recuperado de http://epidemiologia.mspas.gob.gt/ files/Publicaciones%202016/Manuales/Manual%20%20operativo%20de%20Aedes%20 aegypti%20(VIRTUAL).pdf.
Organización Mundial de la Salud (OMS). 2017. Enfermedades transmitidas por vectores. Recuperado de http://www.who.int/es/news-room/fact-sheets/detail/vector-borne-diseases.
Organización Panamericana de la Salud (OPS). 2014. Últimos adelantos técnicos en la prevención y el control del dengue en la Región de las Américas. Informe de reunión. Washington D.C., EE. UU. 83 pp.
Organización Panamericana de la Salud (OPS) / Organización Mundial de la Salud (OMS). 2018. Guatemala: el dengue, chikungunya y Zika se pueden prevenir. Recuperado de https:// www.paho.org/gut/index.php?option=com_content&view=article&id=817:el-denguechikungunya-y-zika-se-pueden-prevenir&Itemid=441
Peña, C. J. y A. Zaglul. 1986. Los mosquitos de la ciudad de Santo Domingo. Ciencia y Sociedad, 11 (2): 178–187.
Quintero, J., H. Brochero, P. Manrique-Saide, M. Barrera-Pérez, C. Basso, S. Romero,
A. Caprara, J. C. De Lima Cunha, E. Beltrán-Ayala, K. Mitchell-Foster, A. Kroeger, J. Sommerfeld y M. Petzold. 2014. Ecological, biological and social dimensions of dengue vector breeding in five urban settings of Latin America: a multi-country study. BMC Infectious Diseases, 14 (38): 1–13.
Rodríguez Sosa, M. A., J. Rueda, Y. E. Vásquez Bautista, R. Fimia-Duarte, M. Borge de Prada, K. Guerrero y P. M. Alarcón-Elbal. 2019. Diversidad de mosquitos (Diptera: Culicidae) de Jarabacoa, República Dominicana. Graellsia, 75 (1): e084.
San Martín, J. L. y O. Brathwaite-Dick. 2007. La Estrategia de Gestión Integrada para la prevención y el control del dengue en la región de las Américas. Revista Panamericana de Salud Pública, 21 (1): 55–63.
Vinicio, M., J. Rodríguez, L. Diéguez, P. M. Yax y J. Iannacone. 2018. Culícidos de relevancia médico-veterinaria de Jutiapa, Guatemala: 2010-2017. Biotempo, 15 (1): 49–58.
[Recibido: 26 de febrero, 2019. Aceptado para publicación: 31 de mayo, 2019]
